普通化学/分子形状
共价分子通过电子对与其他原子键合。由于电子对带负电荷,它们相互排斥,并试图尽可能远离彼此以稳定分子。这种排斥导致共价分子具有独特的形状,称为分子的分子几何形状。有几种不同的方法可以确定分子几何形状。一种称为 VSEPR(价层电子对互斥)模型的科学模型可用于定性预测分子形状。在这个模型中,AXE 方法用于通过计算与分子中心原子(s)相关的电子和键的数量来确定分子几何形状。
VSEPR 模型绝不是分子形状的完美模型!它只是一个系统,它解释了通过实验发现的已知分子几何形状。这可以让我们预测类似分子的几何形状,使其成为一个相当有用的模型。现代定量计算分子最稳定(最低能量)形状的方法可能需要数小时的超级计算机时间,是计算化学的领域。
| 轨道杂化 | |||||
|---|---|---|---|---|---|
| sp |
sp2 | sp3 | sp3d | sp3d2 | |
| 2 组 | 线性 | 弯曲 | 弯曲 | 线性 | |
| 3 组 | 三角平面 | 三角锥形 | T 型 | ||
| 4 组 | 四面体 | 跷跷板形 | 平面正方形 | ||
| 5 组 | 三角双锥 | 四方锥形 | |||
| 6 组 | 八面体 | ||||
杂化由连接到中心原子的“事物”的数量决定。这些“事物”可以是其他原子或非键合电子对。基团数是指连接到中心原子的原子或电子对的数量。例如,甲烷 (CH4) 是四面体形的,因为碳连接到四个氢。然而,氨 (NH3) 不是三角平面形的。它是三角锥形的,因为它连接到四个“事物”:三个氢和一个非键合电子对(以满足氮的八隅体规则)。
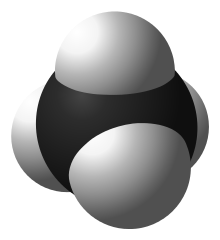
考虑一个简单的共价分子甲烷 (CH4)。四个氢原子在三维空间中围绕一个碳原子。每个 CH 键包含一对电子,这些电子对试图尽可能远离彼此(由于静电排斥)。您可能认为这会导致扁平的形状,每个氢原子相隔 90°。然而,在三维空间中,氢原子的排列更加有效。如果每个氢原子位于以碳原子为中心的四面体的顶点,它们之间的距离约为 cos-1(-1/3) ≈ 109.5°—这是可能的最大值。
为了将四个轨道排列成这种四面体形状,需要将一个 s 轨道和三个 p 轨道重组成一个 sp3 轨道。
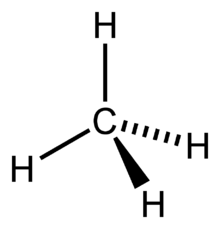
VSEPR 模型以类似于键合电子的方式处理孤对电子。例如,在氨 (NH3) 中,中心氮原子周围有三个氢原子和一对孤对电子。因为有四个基团,氨具有四面体形状,但与甲烷不同的是,氢原子之间的角度略小,为 107.3°。这可以通过理论解释,即孤对电子在物理上比键合电子占据的空间更大。这是一个合理的理论:在一个键中,电子对分布在两个原子之间,而孤对电子只位于一个原子之上。由于孤对电子更大,它迫使其他电子对更靠近。

用水测试这个假设提供了进一步的证据。在水 (H2O) 中,有两个氢原子和两对孤对电子,总共构成四个基团。电子对相互排斥形成四面体形状。氢原子之间的角度为 104.5°,这与我们的模型预期相符。两对孤对电子都将键推得更靠近,导致角度小于氨。
在某些分子中,价电子对少于四对。这发生在硼和铍等电子缺陷原子中,它们不符合八隅体规则(它们分别可以有 6 个和 4 个价电子)。在三氟化硼 (BF3) 中,只有三对电子相互排斥形成一个平面。每个氟原子之间的距离为 cos-1(-1/2) = 120°。在这个分子中形成了一组不同的杂化轨道:2s 轨道和两个 2p 轨道结合形成三个sp2 杂化轨道。剩余的 p 轨道是空的,位于分子的平面之上和之下。
另一方面,铍只形成两对价电子。它们以 cos-1(-1) = 180° 的角度相互排斥,形成一个线性分子。一个例子是氯化铍,它有两个氯原子位于铍原子的相对两侧。这次,一个 2s 轨道和一个 2p 轨道结合形成两个sp 杂化轨道。两个剩余的 p 轨道位于铍原子的上方和一侧(它们是空的)。


有些元素会呈现弯曲形状,而另一些元素则呈线性形状。两者都连接到两个基团上,因此取决于中心原子有多少个孤对电子。
以二氧化硫(SO2)和二氧化碳(CO2)为例。两者都具有两个通过双共价键连接的氧原子。二氧化碳是线性的,而二氧化硫是弯曲的。差异在于它们的价电子层。碳具有四个价电子,而硫具有六个。当它们成键时,碳没有孤对电子,而硫有一个。
回想一下,某些元素,尤其是硫和磷,可以与五个或六个基团成键。杂化分别为sp3d或sp3d2,形状分别为三角双锥或八面体。当存在孤对电子时,就会出现其他形状(见上表)。
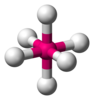
黄色基团代表孤对电子。白色基团代表键合原子,粉色代表中心原子。这被称为AXE方法;A是中心原子,X是键合原子,E是孤对电子。
-
线性
-
平面三角形
-
弯曲
-
四面体
-
三角锥体
-
弯曲
-
三角双锥
-
跷跷板形
-
T形
-
八面体
-
四方锥体
-
平面正方形