结构生物化学/催化
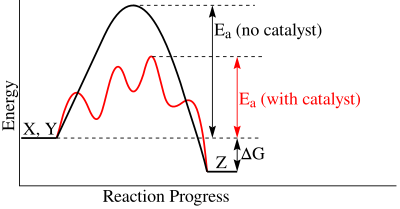
酶最常见的功效之一是催化反应的能力。在反应过程中,反应物必须克服活化能才能生成产物。所需的活化能决定了反应进行所需的时间。活化能越低,反应速率就越快。酶在催化反应中的作用是稳定中间物种,该物种处于活化能的最高点,从而降低活化能。酶与中间态互补,而不是与底物互补。如果酶与底物结合,它实际上会增加活化能。无论有无催化酶,达成的平衡都是相同的。然而,影响的是达到平衡的时间和速率。
一般来说,底物浓度越高,酶越容易与其结合。通过绘制产物生成量随时间的变化曲线,斜率表示底物饱和之前反应发生的速率。该值称为 V0。增加底物浓度将增加 V0。然而,当底物浓度过高时,反应将不再加速,到达一个临界点。该点称为最大速度 Vmax。每种酶都有其独特的 Vmax 值。酶的另一个重要特征是 Km 值,定义为 Vmax 一半时的底物浓度。Km 对每种酶也是独特的。产物生成速率称为 Kcat。将 Kcat 除以 Km 得到酶的效率常数,该常数说明了反应进行的速度以及酶找到底物的可能性。有关更多信息,请参阅催化。
磷酰基转移反应的一个关键特征是,它们通常具有极慢的非酶促速率,因此需要使用催化剂来大幅度加速反应速率。发生在磷酸酯磷原子上的反应也构成了许多生命系统中最重要和最基本过程的化学基础,因为它们允许通过核酸遗传信息的传递,并且也负责利用能量偶联驱动维持细胞健康和活力的热力学不利反应。磷酰基转移反应在代谢途径和信号转导中也发挥着重要作用。
这些磷酰基转移反应中催化的一个可能机制是磷酸单酯的水解。随着 pH 值的降低,水解速率往往会显着增加;这种变化表明磷酸单酯的质子化形式比磷酸单酯二阴离子反应更快。这些反应通常在酶的帮助下快速进行,这可以归因于几个因素。例如,亲核试剂的活化可以通过三种方式之一完成;亲核试剂的位置可以通过增加甚至减少其亲核性来影响亲核试剂。另一种方法是减少静电斥力。酶最重要的特征之一是它们利用结合相互作用和定位基团来进行催化的能力。酶能够直接完成这一点的能力直接将酶的特异性与催化结合起来。
在磷酰基转移反应中,亲核试剂与磷原子以及离去基团的排列也很重要,以便攻击磷原子。另一个可能有助于单酯反应催化的因素是稳定潜在离去基团上的负电荷。还发现,磷酰基转移反应的过渡态可以根据化合物是磷酸单酯、二酯还是三酯,是松散的、紧密的或同步的。磷酸单酯通常通过松散的过渡态进行,二酯通过同步的过渡态进行,而三酯通过紧密的过渡态进行。
磷酰基转移反应中使用的酶中正电荷官能团的存在也会影响反应与转移磷酰基的氧原子的相互作用。
- Berg, Jeremy; Tymoczko, John; Stryer, Lubert. 生物化学,第 6 版。W.H. Freeman and Company. 2007.
Jonathan K. Lassila, Jesse G. Zalatan 和 Daniel Herschlag。“生物磷酰基转移反应:理解机制和催化”。http://www.annualreviews.org/doi/full/10.1146/annurev-biochem-060409-092741?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dpubmed
https://wikibooks.cn/wiki/Structural_Biochemistry/Enzyme
https://wikibooks.cn/wiki/Structural_Biochemistry/Enzyme/Activation_energy
https://wikibooks.cn/wiki/Structural_Biochemistry/Enzyme_Catalytic_Mechanism/Catalysis