结构生物化学/膜蛋白/离子通道
离子通道 是多孔的跨膜蛋白,通过允许离子沿着其电化学梯度通过孔隙扩散来帮助调节跨质膜的电压梯度。它们都通过以圆形排列组装的几个蛋白质亚基来调节穿过质膜的离子流动,其中孔隙中最窄的区域只有几个原子跨度。它们选择性地允许离子通过尺寸或电荷扩散。其他离子通道可能像一个闸门一样起作用,允许离子通过电、温度或其他刺激通过。
环核苷酸通道,也称为 cGMP 通道,是各种细胞(从神经元到精子细胞)的感官信号传导的关键。它们分为两类:经典 cGMP 通道和 CNGK 和 mICNG 型通道。这两类帮助激活机制随着时间的推移而进化。
cGMP 通道在跟踪细胞内 cNMP(环核苷酸)浓度时产生电压响应。环核苷酸[1]通道对 Ca2+ 离子具有渗透性,可以承载混合阳离子电流,因此能够创建化学符号。由于这些特性,cGMP 通道在视网膜光感受器和嗅觉受体神经元的信号通路中发挥重要作用。视网膜中的光感受器通过根据 cGMP(环鸟苷单磷酸)浓度打开或关闭 cGMP 通道来响应光线和黑暗。
在光照下,cGMP 浓度低,光感受器经历短暂的超极化并关闭 cGMP 通道。另一方面,在黑暗中,cGMP 浓度高,cGMP 通道处于开放状态。当 cGMP 通道打开时,这允许稳定的内向电流。与光感受器形成对比,嗅觉受体神经元在受到刺激时会打开 cGMP 通道,而 cGMP 通道在静止时会关闭。
cGMP 通道还可以通过利用神经系统中吸引和排斥分子的分子在引导神经生长锥中发挥作用。cGMP 通道声称的另一个功能是控制海胆精子的趋化性反应。Ca2+ 振荡是由 cGMP 信号通路产生的,这些振荡引导精子。
最近对 cGMP 通道家族的研究发现,细菌和海胆精子研究中发现了新的成员,这些研究侧重于新成员的功能和结构,表明结合单个分子足以打开 cGMP 通道。与经典 cGMP 通道相比,新的 cGMP 通道之间存在几个其他差异。
经典 cGMP 通道是异四聚体,具有 A 和 B 亚基。在哺乳动物中,已知哺乳动物中存在四种不同的 A 亚基和两种不同的 B 亚基。
cGMP 通道有两类:低配体敏感性和高配体敏感性。配体敏感性的差异由配体和 CNBD 之间不同的相互作用来组织。另一种确定配体选择性的方法是 CNGA1 通道中的特定 Asp 残基。侧链具有负的 cGMP 选择性并降低 cAMP 激活效率。
在海胆精子和细菌中发现了新的 cGMP(环核苷酸门控离子通道),这些通道是不合作的,因为它们只需要一个配体分子结合才能打开闸门。

对于眼睛中的光感受器,黑暗中存在高浓度的cGMP;光线在磷酸二酯酶处产生水解。对于嗅觉受体神经元,气味分子启动cAMP 的合成。

cGMP 多肽包含名为 S1-S6 的跨膜结构域。在 Ca、Na 和 K 通道中检测电压的 S4 具有在疏水性氨基酸之间分布的一串带电荷的 Lys 或 Arg 残基。这与经典的 cGMP 通道不同,经典的 cGMP 通道不那么依赖于电压。谷氨酸是 cGMP 的关键成分:在含有孔隙的发夹转折部分,Glu 作为残基携带;在四聚体中,一个 Glu 环提供了一个区域用于组织和移动 Ca+2 离子。
在 C 末端,环核苷酸结合结构域或 CNBD 通过大约 80 个氨基酸连接到 S6,这些氨基酸将配体的结合传递到通道的闸门。据认为,这种连接支持四聚化。
在 cGMP 的 A 和 B 部分,钙调蛋白结合 (CaM) 与 Ca+2 决定了通道的活性。在嗅觉神经元中发现了四种这样的 CaM 结合,但由于它们的 N 和 C 末端结合,只有 B 和 A4 的那些似乎很重要。已发现 CaM 和 Ca+2 之间的结合降低了对配体的敏感性,从而为平稳过渡到静息状态提供了更平滑的过渡。
来自细菌 Mesorhizobium loti 的 mlCNG 通道与经典 cGMP 通道相似,因为它创建了四聚体,并由六个跨膜片段组成,具有 C 末端 CNBD。它与经典 cGMP 通道的不同之处在于它包含了 K 通道的 GYGD 序列(Gly-Tyr-Gly-Asp)。此外,C-连接不是大约 80 个氨基酸,而是大约 20 个氨基酸,这导致它不支持四聚化。
CNGK 结构是 cGMP 通道,其孔隙区域具有 K 通道的序列。CNGK 具有一个大型多肽,该多肽包含四个具有相似序列或“重复”的区域。
科学家正在尝试了解如何同时打开所有四个闸门。他们使用双电子-电子共振 (DEER) 来给出结构并指出残基和构象运动在哪里。
cGMP 通道帮助我们理解配体结合和闸门之间的关系。[2]
钾通道基本上存在于大多数生物体中。钾通道一定很古老,因为许多通道都起源于它们。通常,钾离子有两种类型,六跨膜螺旋电压门控型和二跨膜螺旋内向整流型。通常,钾通道具有 TMxTVGYG 的氨基酸序列。此外,六跨膜螺旋电压门控型通常具有独特的模式,即赖氨酸和精氨酸在序列中每三个或四个位置出现一次。科学家曾在一种称为 KcsA 的细菌蛋白中研究了钾,发现其结构与真核生物非常相似。因此,他们使用 KcsA 作为模型来研究 K+ 通道。
钾通道以孔隙的形式位于质膜中,但不是随机排列的。它起着重要的作用,因为它在体内的许多不同过程中发挥作用,例如激素分泌、调节血管系统等。钾通道在植物中也很重要,因为保卫细胞使用 K+ 通道来控制渗透压流动。钾通道有两个组成部分:过滤器和闸门。过滤器负责选择离子,在本例中为钾,而闸门根据外部环境(例如电压的影响或信号分子)打开和关闭。过滤器的结构类似于血红蛋白的结构,因为它是一个四聚体,具有四个围绕孔隙的重复亚基。此外,这种结构被认为是不对称的。此外,亚基是亲水的。钾离子通过通道的流动非常快。虽然名称是钾通道,但它也允许钠离子通过。然而,钾与钠的比率为 10,000 比 1。钠离子想要穿过通道的另一个原因是这些离子彼此竞争。
由于钾通道与神经信号传导有关,如果通道不能正常工作,这会导致严重的损害。使钾通道仅对 K+ 离子具有渗透性的原因是通道内氧的模拟。钾已知在其周围有水。在通道内壁上形成氧有助于钾离子通过通道的流动。尽管人们对钾通道了解很多,但 K+ 通道在原核细胞中的功能仍然是一个谜。
M2 质子通道位于甲型流感病毒的包膜中。M2 质子通道的结构是由二硫键连接的同四聚体。与钾离子通道相似,它也是一个四聚体,由四个相似的亚基组成。在这种情况下,亚基就是 M2 本身。此外,亚基呈螺旋状,并通过二硫键相互连接。当 pH 值较低时,M2 质子通道的功能最佳。M2 蛋白由三个部分组成:面向细胞外的 24 个氨基酸的 N 端,嵌入膜中的 22 个疏水性氨基酸,以及面向细胞质的 52 个氨基酸的 C 端。[3]
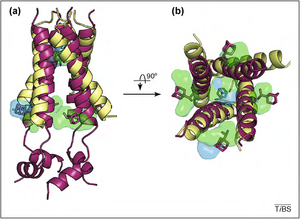
这 22 个氨基酸链形成一个跨膜 α 螺旋。由于氨基酸 Val27 靠近 N 端,因此 M2 通道对质子的选择性非常高。因此,通过通道的质子只能以水分子形式通过,而像水合钠这样的分子很难通过。
质子通道的激活发生在低 pH 环境下。M2 通道的主要功能是允许来自内体的氢离子进入病毒体并降低病毒内部的 pH 值。这会导致围绕病毒基因组的基质蛋白解离,这对于将病毒内容物暴露于宿主细胞的细胞质中至关重要。[4] 两种设计用于阻止 M2 通道功能的药物是金刚烷胺和金刚乙胺。这两种药物可以阻止病毒攻击宿主细胞。然而,由于 M2 容易受到突变的影响,因此使用这些药物变得无济于事。例如,如果膜中一个氨基酸发生改变,药物将无法再阻断病毒。已发现两种 M2 结构:一种是突变的,位于膜中,第二种结构与第一种结构相似,但更长,并且具有 C 端成分。由于病毒对突变的敏感性,跨膜 α 螺旋上的替换导致病毒对抑制剂产生免疫。特别是 Ser31Asn 替换使蛋白高度抵抗金刚烷胺抑制。这种情况在 2009 年的“猪流感”大流行期间最为明显,当时该季节检测到的所有样本都对金刚烷胺及其衍生物金刚乙胺产生了抗性。[5]
历史
[edit | edit source]从 1950 年代初开始,科学家们开始了解离子通道的结构和功能,当时英国生物物理学家艾伦·霍奇金和安德鲁·赫胥黎在 1951 年关于动作电位的研究中分析了离子通道电流的特性,这项研究为他们赢得了诺贝尔奖。离子通道的存在是由伯纳德·卡茨和里卡多·米莱迪在 1971 年间接证实的,后来由埃尔温·内尔和伯特·萨克曼使用膜片钳技术直接证明。2003 年,诺贝尔化学奖授予罗德里克·麦金农,表彰他对离子通道结构的X 射线晶体学研究,以及皮特·阿格雷对水通道蛋白的类似研究。
生物学意义
[edit | edit source]离子通道是神经系统的突出特征,它允许突触之间进行传导。此外,离子通道促进细胞的快速变化,因此作为新型药物的靶标非常有用。然而,离子通道对神经细胞功能的重要性导致动物和植物分泌的毒素的进化,这些毒素靶向中枢神经系统并导致瘫痪。一些例子包括河豚鱼用于防御的河豚毒素和阻断钠通道的奴佛卡因。其他例子包括由黑曼巴蛇产生的树突毒素,它阻断钾离子通道。此外,编码离子通道蛋白的 DNA 中的基因突变会导致相同类型的反应。
注释
[edit | edit source]- ↑ http://www.ncbi.nlm.nih.gov/pubmed/20729090
- ↑ http://www.ncbi.nlm.nih.gov/pubmed/20729090
- ↑ Stouffer AL, Acharya R, Salom D, Levine AS, Di Costanzo L, Soto CS, Tereshko V, Nanda V, Stayrook S, DeGrado WF (2008). "Structural basis for the function and inhibition of an influenza virus proton channel" (PDF). Nature. 451 (7178): 596–9. doi:10.1038/nature06528. PMID 18235504.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Helenius, A. (1992) Unpacking the incoming influenza-virus. Cell 69,577–578
- ↑ Crosby, Niall J; Deane, Katherine; Clarke, Carl E (2003). Clarke, Carl E (ed.). "Amantadine in Parkinson's disease". Cochrane Database of Systematic Reviews. doi:10.1002/14651858.CD003468.
