普通化学/离子键
离子是带电的原子或分子。阳离子带正电,阴离子带负电。当原子获得或失去电子时,就会形成离子。由于电子带负电,失去一个或多个电子的原子会带正电;获得一个或多个电子的原子会带负电。
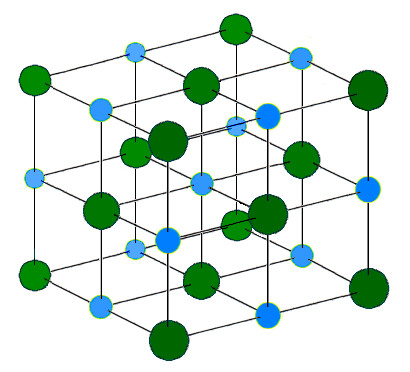
离子键是带正电和带负电的离子之间的吸引力。这些带相反电荷的离子相互吸引,形成离子网络(或晶格)。静电解释了为什么会出现这种情况:异性相吸,同性相斥。当许多离子相互吸引时,它们会形成大而有序的晶格,其中每个离子都被相反电荷的离子包围。通常,当金属与非金属反应时,电子从金属转移到非金属(这是因为金属倾向于具有相对较低的电离能,而非金属倾向于具有较高的电子亲和能)。金属形成带正电荷的离子,而非金属形成带负电荷的离子。离子化合物的最小单元是化学式单元,但这个单元仅仅反映了导致整个晶体中性化的离子比例,例如 NaCl 或 MgCl2。在结构中无法区分单个 NaCl 或 MgCl2 分子。
然而,堆叠可能包含像硝酸铵中的 NH4+ 和 NO3- 这样的分子离子。在这样的结构中,离子是带电荷的分子而不是带电荷的原子。
 |
 |
离子键也可以称为电价键。
离子化合物示例:氯化钠 (),硝酸钾 ().
离子键合物质通常具有以下特征。
- 高熔点(在室温下为固体)
- 坚硬但易碎(会碎裂)
- 许多溶解在水中
- 溶解或熔化时可导电
一般来说,保持晶格结合在一起的力取决于它所包含的离子的电荷乘积。例如,将 NaCl (+1)*(-1) 与 MgO (+2)*(-2) 进行比较表明,氧化镁比氯化钠结合得更牢固,大约是它的 4 倍。这就是为什么氯化钠的熔点比氧化镁低得多,也比氧化镁更容易溶解在水这样的溶剂中。

大多数离子化合物可溶于极性溶剂。极性溶剂只是那些分子具有正负极的溶剂。最常见的极性溶剂例子是水 (H2O)。
它们可溶于极性溶剂的原因是,正离子被溶剂的负极吸引,负离子被溶剂的正极吸引。因此,离子化合物在溶剂中解离或分离成其组成离子。
例如,H2O 由相对更正的氢原子和相对更负的氧原子组成。当像NaCl这样的离子化合物被添加到水中时,正离子会被更负的氧原子吸引,负离子会被更正的氢原子吸引。
这是许多离子化合物非常有用的性质,但并非全部,因为有一些例外,某些化合物无法溶解在某些极性溶剂中。
为了使物质导电,必须有一些电荷载体。例如,在金属中,传输电荷的是围绕正离子的移动电子。
然而,在固态下,离子化合物缺乏任何能够携带电荷的移动粒子,因为保持它们固定在位的静电力非常强,离子无法在晶格内移动。当化合物溶解或熔化时,这种情况会发生变化。当溶解时,离子会解离,并能够四处移动。熔融离子化合物也是如此。这就是为什么熔融和溶解的离子化合物可以导电,而固态离子化合物不能导电。

当金属和非金属发生化学反应时,就会形成离子键。由于金属的电离能较低,失去电子形成完整的价电子层后,不会变得非常不稳定,并带正电。而由于非金属的电子亲和力较大,获得电子形成完整的价电子层后,会变得非常稳定,并带负电。当金属和非金属反应时,金属会失去电子,并将电子转移给非金属,非金属则会获得电子。整个过程 - 少量的损失加上大量的获得 - 导致能量的净降低。因此,会形成离子,这些离子会立即相互吸引,从而形成离子键。
例如,在钠(Na)和氯(Cl)的反应中,每个Cl原子从Na原子中获得一个电子。因此,每个Na变成Na+阳离子,而每个Cl原子变成Cl-阴离子。由于它们带相反的电荷,它们相互吸引,并与数百万个其他离子结合形成离子晶格。这种大规模集体堆叠产生的晶格能进一步稳定了新化合物。晶格中的化学式(正负离子的比例)是**NaCl**,即正负电荷数相等,从而保证了中性。
电荷必须保持平衡,否则大部分电荷之间的排斥力将变得难以克服。在氯化镁的情况下,镁原子会释放两个电子以变得稳定。请注意,它位于第二族,因此有两个价电子。氯原子只能接受一个电子,因此每个镁离子必须有两个氯离子。因此,氯化镁的化学式为**MgCl2**。如果形成氧化镁,其化学式将为**MgO**,因为氧可以接受镁的两个电子。
还需要注意的是,一些原子可以形成多种离子。这通常发生在过渡金属中。例如,铁(Fe)可以变成Fe2+(称为亚铁),II)或 - 使用旧的名称 - 亚铁。Fe也可以变成Fe3+(称为铁),III)或 - 有时仍然 - ferric。
常见离子
[edit | edit source]离子键通常发生在金属和非金属之间的反应中,但也存在一些称为多原子离子的分子,它们也会发生离子键。在这些多原子离子中,可能存在共价键(或极性键),但作为一个整体,它们会发生离子键。存在无数的多原子离子,但你应该熟悉最常见的那些。建议你记住这些离子。
| 名称 | 化学式 | 名称 | 化学式 |
|---|---|---|---|
| 铵 | NH4+ | 水合氢离子 | H3O+ |
| 过氧化物 | O22- | 氢氧根 | OH- |
| 亚硝酸根 | NO2- | 硝酸根 | NO3- |
| 亚硫酸根 | SO32- | 硫酸根 | SO42- |
| 亚硫酸氢根 | HSO3- | 磷酸根 | PO43- |
| 次氯酸根 | ClO- | 亚氯酸根 | ClO2- |
| 氯酸根 | ClO3- | 高氯酸根 | ClO4- |
| 碳酸根 | CO32- | 碳酸氢根 | HCO3- |


