结构生物化学/酶/可逆抑制剂
酶抑制剂是与酶结合并导致其活性降低的分子或化合物。抑制剂可以与酶结合并阻止底物进入酶的活性位点,或防止酶催化化学反应。抑制剂有两类。
- 不可逆抑制剂
- 可逆抑制剂
抑制剂也可能自然存在,并可能参与代谢调节。例如,抑制剂引起的负反馈有助于维持细胞内的稳态。其他细胞酶抑制剂包括专门与酶靶标结合并抑制其活性的蛋白质。这对于消除有害酶(如蛋白酶和核酸酶)很有用。
酶抑制剂的例子包括毒物和许多不同类型的药物。
可逆抑制剂可以通过弱的非共价相互作用(如离子键、疏水相互作用和氢键)与酶结合。由于可逆抑制剂不与酶形成任何化学键或反应,因此它们形成速度快,并且可以很容易地去除;因此,与不可逆抑制相比,酶-抑制剂复合物快速解离。
可逆抑制的例子
不可逆抑制的例子
- 基团特异性:仅与特定化学基团反应。
- 反应性底物类似物(亲和标记):结构与底物类似的抑制剂,并与活性位点结合。
- 基于机制的抑制剂(自杀抑制剂):酶在活性位点将抑制剂转化为反应性形式。
可以通过增加底物浓度来克服竞争性抑制,而无法克服非竞争性和非竞争性抑制。
不可逆抑制剂共价结合到酶上,引起酶活性位点的化学变化,并且不可逆转。不可逆抑制剂的主要作用包括修饰酶活性所需的关键氨基酸残基。它们通常含有反应性官能团,如醛、烯烃或苯磺酸酯。这些亲电基团能够与氨基酸侧链反应形成共价加合物。氨基酸成分是含有亲核侧链(如羟基或巯基)的残基,如丝氨酸、半胱氨酸、苏氨酸或酪氨酸等氨基酸。
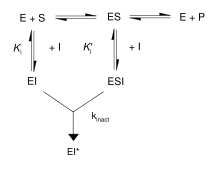
首先,不可逆抑制剂与酶形成可逆的非共价复合物(EI 或 ESI)。然后,该复合物反应生成共价修饰的不可逆复合物 EI*。EI* 形成的速率称为失活速率或 kinact。可以通过底物或第二个可逆抑制剂的竞争来阻止不可逆抑制剂的结合,因为 EI 的形成可能与 ES 竞争。
此外,一些可逆抑制剂可以通过与它们的靶酶紧密结合来形成不可逆产物。这些紧密结合的抑制剂表现出类似于共价不可逆抑制剂的动力学。如图所示,这些抑制剂以低亲和力的 EI 复合物快速与酶结合,然后经历缓慢的重排以形成非常紧密结合的 EI* 复合物。这种动力学行为称为慢结合。慢结合通常涉及酶“合拢”以包围抑制剂分子的构象变化。这些慢结合抑制剂的一些例子包括重要的药物,如甲氨蝶呤和别嘌呤醇。
可逆抑制剂非共价结合到酶上,并且可以发生许多不同类型的抑制,具体取决于抑制剂结合的位置。抑制剂与酶之间的非共价相互作用包括氢键、疏水相互作用和离子键。许多这些弱键结合在一起产生强而特异的结合。与底物和不可逆抑制剂相比,可逆抑制剂在结合到酶上时通常不会发生化学反应,并且可以通过稀释或透析轻松去除。
可逆抑制剂有三种类型:竞争性、非竞争性/混合性和非竞争性抑制剂。
- 竞争性抑制剂,顾名思义,与底物竞争同时与酶结合。抑制剂对酶的活性位点具有亲和力,底物也在该位点结合。可以通过增加底物浓度来克服这种抑制,从而胜过抑制剂。竞争性抑制剂在结构上通常与真正的底物相似。
- 非竞争性抑制剂与酶的底物同时与酶结合。但是,抑制剂的结合会影响底物的结合,反之亦然。这种抑制无法克服,但可以通过增加底物浓度来减少。抑制剂通常遵循变构效应,即它与酶上不同于底物的位点结合。这种与变构位点的结合改变了酶的构象,从而降低了底物对活性位点的亲和力。
- 非竞争性抑制剂结合到其他位点(变构位点),而不是活性位点,并通过改变活性位点的形状来阻止酶的活性(由破坏保持酶分子在其 3D 形状中的正常氢键和弱疏水相互作用的排列引起的。这种扭曲会传递到活性位点,使其不合适)。因此,与竞争性抑制不同,底物浓度毫无意义。
一些可逆抑制剂的例子:
乙酰胆碱酯酶抑制剂:通常缩写为 AChEI 或抗胆碱酯酶,它是一种化学物质,抑制乙酰胆碱酯酶分解乙酰胆碱。这最终会导致神经递质乙酰胆碱的水平和作用时间增加。
单胺氧化酶 A (maoA) 的可逆抑制剂:maoA 抑制剂包括广泛的天然药物和精神药物,它们暂时且可逆地抑制单胺氧化酶。maoA 抑制剂最常用于对抗抑郁症和轻度抑郁症。

大多数可逆抑制剂遵循经典的米氏方程,其中酶 (E) 与其底物 (S) 结合形成酶-底物复合物 (ES)。km 是米氏常数,对应于速度为最大速度一半时的底物浓度。Vmax 是酶的最大速度。
- 竞争性抑制剂只能与 E 结合,而不能与 ES 结合。它们通过干扰底物的结合来增加 Km,但它们不影响 Vmax,因为抑制剂不会改变 ES 中的催化作用,因为它无法与 ES 结合。

-
显示竞争性抑制的图
-
竞争性抑制也可以是变构的,只要抑制剂和底物不能同时与酶结合
-
变构竞争性抑制的另一种可能机制
- 非竞争性抑制剂只能与 ES 复合物结合。因此,这些抑制剂由于结合效率提高而降低了 Km,并且由于它们会干扰底物结合并阻碍 ES 复合物中的催化作用而降低了 Vmax。

- 混合抑制剂可以与 E 或 ES 复合物结合,但对其中一个有偏好。这可以分别增加或减少 Km。两者都会导致 Vmax 降低。
- 非竞争性抑制剂对 E 和 ES 的亲和力相同。它们不会改变 Km,但会降低 Vmax。


-
非竞争性或混合抑制可能机制的说明




