结构生物化学/蛋白质/纯化/等电聚焦
等电点,也称为蛋白质的pI,是指蛋白质净电荷为零时的pH值。等电聚焦是一种分离技术,根据蛋白质的等电点(或其残基的酸碱度)分离肽。带有pH梯度的凝胶被用作介质。pH梯度通过将具有不同pI的多电荷聚合物(即两性电解质)添加到凝胶中来形成。然后将样品置于凝胶上并施加电压。蛋白质将沿着凝胶移动,直到它们达到它们的等电点。换句话说,每种蛋白质都会移动直到它到达凝胶中pH值等于蛋白质pI的位置。然后可以去除在给定pH值下形成的蛋白质带并进一步分析。该过程可以成功地分离净电荷差大于或等于1的蛋白质。
等电点(pI):蛋白质净电荷为零时的pH值。对于具有许多碱性氨基酸的蛋白质,pI将较高,而对于酸性蛋白质,pI将较低。
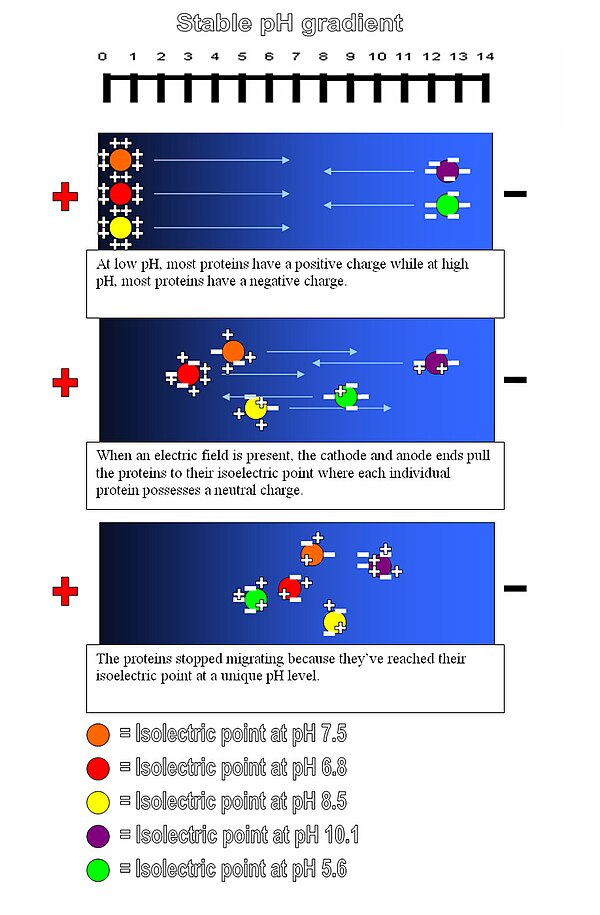
等电聚焦是一种区域电泳,通常在凝胶中进行,它利用了这样一个事实,即分子的电荷会随着其周围环境的pH值而变化。在低于其等电点(pI)的pH区域中的蛋白质将带正电荷,因此将迁移到阴极。然而,随着它迁移,电荷会减少,直到蛋白质到达与其pI对应的pH区域。此时它没有净电荷,因此迁移停止。结果,蛋白质被聚焦成尖锐的静止带,每种蛋白质位于与其实际pI对应的pH梯度中的一个点。该技术能够实现极高的分辨率,即使差异仅为一个电荷的蛋白质也能被分馏成单独的带。
要聚焦的分子分布在具有pH梯度的介质上(通常由脂肪族两性电解质产生)。电流通过介质,产生“正”阳极和“负”阴极端。带负电荷的分子通过介质中的pH梯度迁移到“正”端,而带正电荷的分子迁移到“负”端。当一个粒子向与其电荷相反的极移动时,它会穿过不断变化的pH梯度,直到它到达一个点,在那里达到该分子的等电点的pH值。此时,分子不再具有净电荷(由于相关官能团的质子化或去质子化),因此不会在凝胶中继续移动。在添加目标粒子之前,首先通过对含有不同pI值的少量分子(如两性电解质)的溶液进行电泳来建立梯度。
该方法应用于蛋白质研究,蛋白质根据其酸性和碱性残基的相对含量进行分离,其值由pI表示。将蛋白质引入到由聚丙烯酰胺、淀粉或琼脂糖组成的固定pH梯度凝胶中,其中已建立了pH梯度。等电聚焦可以解析pI值相差仅0.01的蛋白质。等电聚焦是二维凝胶电泳的第一步,其中蛋白质首先根据其pI进行分离,然后通过SDS-PAGE进一步根据分子量进行分离。
当我们知道其pKa值时,我们可以通过用NaOH滴定来确定每个氨基酸的pI。例如,最小的氨基酸甘氨酸有两个pKa值,分别为2.34和9.60。[1]
首先,加入强酸并使甘氨酸完全质子化。然后逐渐加入NaOH,直到pH升至2.34。此时,我们使用0.5摩尔的NaOH相当于甘氨酸的第一个质子化形式。此外,溶液中会生成0.5摩尔的第二质子化形式。在使用1摩尔的NaOH相当于第一个质子化形式后,将只剩下第二质子化形式。我们将看到甘氨酸的第二质子化形式是两性离子,它是净电荷为零的分子。因此,此时pH被称为等电点(pI),等于5.97。继续加入NaOH,直到pH等于9.60。此时,溶液中存在0.5摩尔的第三质子化形式,NaOH的总量为1.5摩尔。回到pI,我们看到
然后我们可以写成一般形式
备注 要确定具有两个以上pKa值的氨基酸的pI,我们将使用覆盖两性离子存在于溶液中的范围内的两个pKa值。[2]