普通化学/各种元素的化学/第 14 族
第 14 族 (IVA) 包括 碳、硅、锗、锡 和 铅。碳是非金属,硅和锗是类金属,锡和铅是金属。
碳族元素具有 4 个价电子,倾向于形成共价化合物。随着质量和原子半径的增加,这些元素变得越来越金属化,熔点和沸点也越来越低。
第 14 族元素很难形成气态氢化合物。这些化合物要么不稳定,要么易燃。除了铅之外,所有元素都能在 +4 氧化态下形成氧化物、硫化物和卤化物。+4 氧化态在碳、硅和锗中占主导地位;锡中同时出现 +2 和 +4 氧化态,铅中以 +2 氧化态为主。所有这些元素都形成 +4 态的卤化物,它们是共价的。
碳化合物比硅、锗、锡或铅的类似化合物更 共价。更重要的是,碳可以与自身或其他元素形成双键甚至三键,形成其他重元素无法形成的化合物,如乙炔 (C2H2)。硅和该族的其他重元素只能形成单键。
因此,二氧化碳 CO2 在常温下是气体,因为碳和氧之间的双键形成了单个分子,但二氧化硅 SiO2 形成一种称为石英的坚硬岩石,因为它是一种 共价网络固体。每个硅原子通过单键与四个不同的氧原子键合,每个氧原子与两个硅原子键合。锗、锡和铅的氧化物具有类似的性质。二氧化碳溶解在水中形成碳酸,碳酸是一种弱酸,与碱反应形成碳酸盐;该族的其他元素的氧化物在水中几乎不反应。
由于碳在化学中具有无与伦比的重要性,因此它是我们研究第 14 族元素的重点。 |
碳是一种非常重要的元素。它在地球和大气中含量丰富,并且存在于构成所有生物的物质中。碳具有许多使其与其他元素不同的性质,因此值得深入研究。

同素异形体是纯元素的不同形式。碳有几种同素异形体,其中三种很常见。
- 无定形碳是煤和炭黑。碳分子以共价键结合,但没有顺序或排列。
- 石墨发生在碳形成扁平共价网络时。这些扁平的“片层”彼此之间没有键合,使它们可以自由滑动。石墨构成铅笔中的“铅”。
- 金刚石发生在碳形成三维共价网络时。金刚石与石墨和无定形碳大不相同。它们是透明的、闪闪发光的,并且非常坚硬。金刚石只能在高温和高压下形成。
碳还有几种稀有且奇特的同素异形体,包括
- 富勒烯,或称巴基球,是球形的碳球。共价键将碳原子连接成足球状图案,看起来很像巴克明斯特·富勒的球形穹顶。最常见的富勒烯具有 C60 的分子式。富勒烯足够大,可以让一个小原子被困在里面。
- 笼状石墨在陨石撞击地球时形成。
- 碳纳米管是由碳制成的非常小但坚硬的管子。它们是在实验室中制造的,是研究的主题。
请记住,同素异形体仅由一种元素组成。在这种情况下,这些同素异形体仅包含碳原子,不包含其他元素。
虽然碳主要以其有机化合物而闻名,但它确实形成了许多重要的无机化合物。
碳的氧化物仅包含碳原子和氧原子。有两种氧化物很常见
- 一氧化碳 (CO):当含碳燃料在氧气有限的情况下燃烧时释放的有毒气体。
- 二氧化碳 (CO2):自然存在于空气中,但含量过多被认为是污染。动物呼出二氧化碳,植物吸收二氧化碳。它略带酸性。二氧化碳在固态时为“干冰”。
还有其他可能形成的氧化物,但它们不稳定或不自然

- 二氧化三碳 (C3O2):由双键组成,末端为氧。O = C = C = C = O。它分解成二氧化碳和二氧化碳。
- 二氧化碳 (C2O):反应性很强。仅包含双键,但末端碳有一个非键合对。
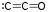
- 三氧化碳 (CO3):存在于三种不同的形状中,非常不稳定
碳酸是由二氧化碳溶解在水中形成的。它由以下反应给出

碳酸盐 和 碳酸氢盐 是碳形成的两种离子。
它们的化学式分别是 CO32- 和 HCO3-。
离子化合物
[edit | edit source]除了氧阴离子(碳酸盐和碳酸氢盐)外,碳还可以形成几种其他的离子。

- 氰化物 (CN-)
- 氰酸根 (OCN-)
- 硫氰酸根 (SCN-)
- 碳化物 (C22- 和 C34-)
氰化氢是一种极其危险的气体,会干扰细胞代谢导致死亡。它曾被用于处决和种族灭绝,最臭名昭著的是在纳粹大屠杀期间。 |
合金
[edit | edit source]碳被用于一些合金中,合金是金属的混合物。如果将少量(按重量计 0.2% 到 2.1%)的碳混合到铁中,就会得到钢。
有机化合物
[edit | edit source]
含有碳的化合物(上述无机化合物除外)被认为是有机的。它们曾经被认为只由生物体产生,但后来在实验室中被人工合成。大多数有机化合物除了碳之外还含有氢。
许多物质都是有机化合物。聚合物是有机化合物,由包含碳和其他原子的重复模式的长链组成。塑料、橡胶和尼龙都是有机聚合物。碳氢化合物是只含有氢和碳的化合物,甲烷就是一个简单的例子。原油是各种混合在一起的碳氢化合物的泥浆。丙烷、丁烷和辛烷是众所周知的用作燃料的碳氢化合物。也许最有趣的有机化合物类型是生物分子。碳水化合物、蛋白质、脂类(脂肪)和核酸(如 DNA)是最基本的生物分子。它们也是聚合物(脂类除外),由长链的小的重复化学物质通过键合在一起形成。生物分子构成了构成所有生物体的活细胞中发现的化学物质。
有机化学和生物化学是十分广泛而深入的学科。它们远远超出了普通化学的范围。幸运的是,你对普通化学的知识足以开始华夏公益教科书的有机化学 和 生物化学,如果你感兴趣的话。
硅
[edit | edit source]
硅存在于半导体中,半导体是所有电子设备的基础。它的电子构型使它能够捐赠或接受电子。当纯硅被“掺杂”具有比硅更多或更少电子的元素时,轻微不纯的硅就变成了半导体。这些物质通过充当开关来构成复杂的电子设备,该开关可以根据电信号打开或关闭。
硅在自然界中不以游离状态存在;它最常见于二氧化硅(包括非常常见的岩石石英和大多数沙粒)和硅酸盐中。大多数硅酸盐是不溶的。所谓的“神奇岩石”与溶解在水中的硅酸钠发生反应,然后与一些溶解的金属盐的离子发生反应,形成岩石状硅酸盐柱。
二氧化硅是一种坚硬的物质,只有在高温下才能熔化,它的化学性质与二氧化碳截然不同,二氧化碳在冻结成干冰之前是气体。熔融二氧化硅可以铸造成玻璃,玻璃是一种坚硬而有用的材料,能抵抗除氟、氢氟酸和强碱以外几乎所有化学物质的侵蚀。玻璃在家庭容器和饮具中非常有用,因为它耐化学物质、耐热,并能抵抗微生物的侵蚀。玻璃如果纯净或含有某些化学物质,可以非常透明,或者可以呈现出迷人的颜色,使其成为艺术品的首选材料。一些小型生物将海中的溶解二氧化硅转化为它们的壳来创建结构。种类繁多的硅化合物被称为硅树脂,具有广泛而多样的用途。
二氧化硅严格来说不是毒药,但作为一种研磨剂,如果食用或吸入,可能会磨损组织而造成损伤。石棉是一种硅酸盐(也是二氧化硅的衍生物),尤其是在肺部会分解成二氧化硅,并造成巨大损害。 |

其他
[edit | edit source]锗是另一种用于半导体的元素。在晶体管普及之前,锗二极管在无线电中被大量使用。
锡被认为是一种“差金属”。它在标准状态下有两种同素异形体:灰锡 和 白锡。灰锡具有非金属特性,而白锡是金属。锡经常被用作合金。“锡罐”实际上是镀锡的钢罐,以防止腐蚀。白锡是一种主要由锡组成的铜锡合金。青铜是一种主要由铜组成的铜锡合金。焊料是锡铅合金,因其熔点低而被用于连接电线。
铅是一种重金属,呈灰色。它曾被广泛使用,但现在已知如果摄入,它会成为神经毒素。运水管以前用铅制成,但现在用铜或塑料制成,因为铅可能会污染水。铅化合物,尤其是易溶于水(如醋酸铅,在罗马时代曾用作葡萄酒的防腐剂和甜味剂)或胃酸(如以前用于油漆中的氧化铅)或以气态或液态形式(如以前用于汽油中的四乙基铅)和铅粉都是非常危险的。铅在食品、油漆和汽车燃料中的使用现在几乎在世界各地都被禁止。
铅化合物和蒸气是阴险的毒物,会积聚在大脑中,造成学习障碍和人格障碍。 |
铅水晶玻璃中含有氧化铅,但它与二氧化硅紧密结合,因此不易逸出。铅笔“芯”实际上不是铅,而是无害的石墨(实际上是碳)与粘土结合在一起。铅仍然在汽车电池(其中含有比铅更危险的硫酸)和核用途(作为比铅金属更危险的辐射屏蔽)中发挥作用。
| 铅氧化物很容易被还原。 | |
| 铅不溶于盐酸或硫酸,但会溶于硝酸,因为硝酸是一种强氧化剂。 | |
| 加入碱性溶液中,氧化铅(II)会形成亚铅酸盐离子。 | |
| 亚铅酸盐在氯化时会形成氧化铅(IV)。 | |
| 将氧化铅(IV)加入碱性溶液中会形成铅酸盐离子。 |