有机化学/烯烃
烯烃的命名方式与烷烃类似,但将“-烷”后缀改为“-烯”。如果烯烃只含有一个双键,并且该双键为末端键(双键位于分子的末端或其他末端),则不需要在名称前添加任何数字。
丁烷:C4H10(CH3CH2CH2CH3)
丁烯:C4H8(CH2=CHCH2CH3)
如果双键不是末端键(如果它位于链的中间碳上),则应对碳进行编号,使两个双键碳中的第一个具有最小的编号,并将该编号与“-烯”后缀用连字符连接,如下所示。
正确:戊-2-烯(CH3CH=CHCH2CH3)
不正确:戊-3-烯(CH3CH2CH=CHCH3)
第二个不正确,因为将公式水平翻转会导致烯烃的编号更低。
如果烯烃中有多个双键,则应在分子名称中对所有键进行编号,即使是末端双键也是如此。编号应从最低到最高,并用逗号分隔。IUPAC 数字前缀用于指示双键的数量。
辛-2,4-二烯:CH3CH=CHCH=CHCH2CH2CH3
癸-1,5-二烯:CH2=CHCH2CH2CH=CHCH2CH2CH2CH3
请注意,上面的“2-4”编号产生了两个双键仅被一个单键隔开的分子。这种条件下的双键被称为“共轭”,它们代表构象的增强稳定性,因此在许多情况下和组合中,它们在能量上被认为是优先的反应物。
在立体化学中,我们之前讨论过顺反异构体符号,其中顺式表示同一侧,反式表示相对侧。然而,烯烃可能会出现一个独特的问题,因为顺反异构体符号有时会失效。首先要记住的是,烯烃是平面的,并且键没有旋转,正如我们稍后将讨论的。因此,当取代基位于双键的一侧时,它会保持在该侧。
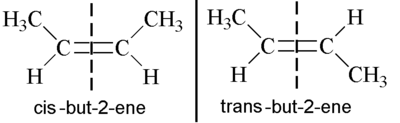
上面的例子非常直截了当。在左侧,我们有两个甲基位于同一侧,因此它是顺-丁-2-烯。在右侧,它们位于相对侧,因此我们有反-丁-2-烯。因此在这种情况下,顺反异构体符号有效,事实上,这些是正确的名称。

从上面的例子来看,你将如何使用顺式和反式?哪一个是同一侧,哪一个是相对侧?当烯烃具有 3 或 4 个不同的取代基时,必须使用所谓的 EZ 命名法,来自德语单词 Entgegen(相对)和 Zusammen(相同)。
|
E:Entgegen,双键的相对侧 |
让我们从 (Z)-3-甲基戊-2-烯开始。我们首先将烯烃分成左右两部分。在每侧,我们将一个取代基指定为高优先级取代基或低优先级取代基。优先级基于取代基的原子序数。因此,在左侧,氢的优先级最低,因为它的原子序数是 1,而碳的原子序数是 6,所以优先级更高。
在右侧,我们在顶部和底部都有碳取代基,因此我们继续到下一个键。在顶部,还有另一个碳,但在底部,有一个氢。因此,顶部具有高优先级,底部具有低优先级。
因为两侧的高优先级位于同一侧,所以它们是 Zusammen(作为助记符,可以想象 'Zame Zide')。
现在让我们看一下 (E)-3-甲基戊-2-烯。在左侧,我们在同一侧具有相同的取代基,因此优先级与 Zusammen 版本相同。然而,取代基在右侧反转,高优先级取代基位于底部,低优先级取代基位于顶部。因为高优先级和低优先级在左右两侧相反,所以它们是 Entgegen,或相反。
这个系统需要一些时间来习惯,并且通常给出一个烯烃的名称比给出一个名称写出一个烯烃更容易。但是,经过一些练习,你会发现它非常容易。
| (Z)-丁-2-烯 | (E)-丁-2-烯 |
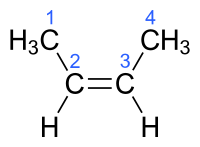 |

|
| 顺-丁-2-烯 | 反-丁-2-烯 |
在一定程度上,可以将 Z 型构型视为顺式异构体,将 E 型构型视为反式异构体。这种对应关系仅在两个碳原子具有相同取代基时才是精确的。
一般来说,只有在每个双键碳原子都具有氢原子(即 R-CH=CH-R')时才应使用顺反异构体。
烯烃是含有至少两个 sp2 杂化的碳原子的碳与氢键合的分子。也就是说,至少有一个碳-碳双键,其中碳原子除了在σ(西格玛)键中共享一对电子外,还在它们之间共享一对电子,形成π(派)键。
脂肪族烯烃的通式为:CnH2n -- 例如 C2H4 或 C3H6
由于π键的特性,烯烃在两个原子之间的双键周围的旋转非常有限。为了使烯烃结构旋转,π键必须首先断裂 - 这需要每摩尔约 60 或 70 千卡的能量。因此,烯烃根据每个原子位于键的哪一侧具有不同的化学性质。
例如,2-丁烯存在两种非对映异构体
| (Z)-丁-2-烯 | (E)-2-丁烯 |
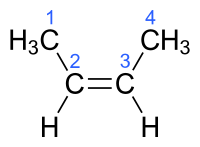 |

|
| 顺-丁-2-烯 | 反-丁-2-烯 |
观察氢气加成到 1-丁烯、(Z)-2-丁烯和 (E)-2-丁烯的反应,我们可以看到所有产物都是丁烷。反应之间的区别在于每个反应都有不同的能量:1-丁烯为 -30.3 千卡/摩尔,(Z)-2-丁烯为 -28.6 千卡/摩尔,(E)-2-丁烯为 -27.6 千卡/摩尔。这说明丁烯异构体的三种种类在稳定性方面存在差异,这是由于它们还原后可以释放的能量不同造成的。
可以根据以下概念估算烯烃的相对稳定性
- 内烯烃(双键不在末端碳上)比末端烯烃(双键在末端碳上)更稳定。
内烯烃比末端烯烃更稳定,因为它们与链上的更多碳原子相连。由于末端烯烃位于链的末端,双键仅与一个碳原子相连,被称为伯(1°)。伯碳是最不稳定的。在链的中间,双键可以与两个碳原子相连。这被称为仲(2°)。最稳定的将是叔(4°)。
- 通常,烯烃中 sp2 杂化的碳上连接的烷基越多且越庞大,该烯烃就越稳定。
- 反式双键比顺式双键更稳定。
有几种方法可以生成烯烃。[1] 这些方法中的一些,例如 Wittig 反应,我们只会在本章中简要介绍,并在本书的后面更详细地介绍。现在,知道它们是生成烯烃的方法就足够了。

卤代烷通过脱卤化氢转化为烯烃:消除卤化氢的元素。脱卤化氢涉及从带卤素的碳原子相邻的碳原子上去除卤素原子以及氢原子。它使用 E2 消除机理,我们将在本章末尾详细讨论。卤代烷必须在相邻碳原子上具有 180° 的氢和卤素。如果在相邻碳原子上没有与卤素成 180° 的氢,则反应不会发生。毫不奇怪,消除相当于酸分子所需试剂是强碱,例如:醇性 KOH。
在某些情况下,这种反应会产生单一烯烃,而在其他情况下会产生混合物。例如,正丁基氯只能从 C-2 消除氢,因此只产生 1-丁烯。另一方面,仲丁基氯可以从 C-1 或 C-3 消除氢,因此产生 1-丁烯和 2-丁烯。当可以形成两种烯烃时,2-丁烯是主要产物。


邻二卤代烷(在两个相邻碳原子上的卤素,想想“邻近”)的脱卤素是合成烯烃的另一种方法。反应可以使用丙酮溶液中的碘化钠进行,也可以使用乙醇或乙酸溶液中的锌粉进行。
这种反应也可以用镁在乙醚中进行,尽管机理不同,因为这实际上产生了一种格氏试剂作为中间体,该试剂会与自身反应并导致消除,从而产生烯烃。

醇通过脱水转化为烯烃:消除水分子。脱水需要酸的存在和加热。通常用两种方法之一进行:将醇与硫酸或磷酸一起加热到 200°C 的温度,或者将醇蒸气在 350-400°C 下通过氧化铝 Al2O3,氧化铝在这里充当路易斯酸。
醇脱水的难易程度:3° > 2° > 1°
当可以形成异构烯烃时,我们再次发现一种异构体占主导地位的趋势。因此,仲丁醇可以产生 2-丁烯和 1-丁烯,但实际上几乎只产生 2-异构体
正丁醇生成 2-丁烯说明了脱水的一个特征,该特征不是脱卤化氢共有的:双键可以在与最初带有 -OH 基团的碳原子相距很远的位置形成。这个特征将在后面解释。主要是因为双键出现位置的确定性更高,脱卤化氢通常比脱水更受青睐作为制备烯烃的方法。
炔烃还原到双键阶段可以产生顺式烯烃或反式烯烃,除非三键在链的末端。哪个异构体占主导地位取决于还原剂的选择。
用钠或锂在液氨中还原炔烃得到主要是反式烯烃。用多种不同的催化剂氢化炔烃几乎完全得到顺式烯烃(高达 98%):一种专门制备的钯,称为 Lindlar 催化剂;或一种硼化镍,称为 P-2 催化剂。
因此,这些反应中的每一个都具有高度的立体选择性。炔烃顺式还原的立体选择性一般归因于两个氢原子附着在催化剂表面上的炔烃同侧;据推测,这种相同的立体化学适用于末端炔烃的氢化,末端炔烃不能产生顺式和反式烯烃。
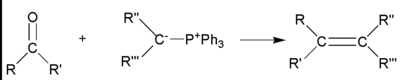
在继续讨论反应之前,我们需要绕道讨论一个在烯烃反应中非常重要的主题,“马氏规则”。这是俄罗斯人弗拉基米尔·马尔科夫尼科夫在 1869 年提出的一个简单规则,当时他展示了 HBr 加成到烯烃的取向。
他的规则指出:“当不对称烯烃与卤化氢反应生成卤代烷时,氢原子加成到烯烃中具有较多氢取代基的碳原子,卤素加成到烯烃中具有较少氢取代基的碳原子”(这条规则通常被比喻为“富人更富,穷人更穷”。也就是说,氢原子最多的碳原子得到另一个氢原子,氢原子最少的碳原子得到卤素)。
这意味着亲电试剂-亲核试剂对的亲核试剂与最有利于碳正离子或过渡态中部分正电荷的位置相连。
这里 Br 连接到中间碳而不是末端碳,这是由于马氏规则,这种产物被称为马氏产物。
马氏产物
[edit | edit source]遵循马氏规则的反应的产物被称为马氏产物。
马氏加成
[edit | edit source]马氏加成是一种遵循马氏规则的加成反应,生成马氏产物。
反马氏加成
[edit | edit source]某些反应会生成与马氏产物相反的产物,称为反马氏产物。也就是说,氢最终位于双键上取代程度更高的碳原子上。我们稍后将讨论的硼氢化/氧化反应就是一个例子,在过氧化物中进行的反应也是如此。
马氏规则的现代版本通常解释了“反马氏”行为。原始的马氏规则预测,在双键上添加的氢(亲电试剂)最终将位于具有更多氢的碳上。将其推广到所有亲电试剂,实际上是亲电试剂最终位于具有最多氢的碳上。通常氢起着亲电试剂的作用;但是,氢在某些反应中也可以作为亲核试剂。以下是对马氏规则的扩展更通用
"当烯烃发生亲电加成时,亲电试剂加成到具有最多氢取代基的碳原子上。亲核试剂加成到取代程度更高的碳原子上。"
或者更简单地说
"第一个加成的物质加成到具有最多氢的碳原子上。"
一些反应可靠地生成反马氏产物这一事实实际上是有机化学中一个强大的工具。例如,在我们下面讨论的反应中,我们将展示两种从烯烃中生成醇的不同方法:氧汞化-还原和硼氢化/氧化。氧汞化生成马氏产物,而硼氢化生成反马氏产物。这为有机化学家提供了选择产物的选择,而不必局限于可能不是最理想的单一产物。
为何有效
[edit | edit source]马氏规则之所以有效,是因为碳正离子中间体的稳定性。实验表明碳正离子是平面分子,碳具有三个取代基,彼此之间成 120° 角,并且有一个空空的 *p* 轨道垂直于它位于第三个平面上。*p* 轨道延伸到三取代平面的上方和下方。
这导致了一种称为超共轭的稳定效应。超共轭是指当一个未填充(反键或空)C-C π 轨道和一个填充的 C-H σ 键轨道彼此相邻时发生的情况。结果是填充的 C-H σ 轨道与未填充的 C-C π 轨道相互作用并稳定分子。分子取代程度越高,超共轭的机会就越多,因此分子越稳定。
另一种稳定效应是诱导效应.
规则的例外
[edit | edit source]马氏规则有一些例外,这些例外对于有机合成非常重要。
- 过氧化氢中的 HBr:由于自由基的形成以及其反应机理,烷基自由基在中间原子处形成,在那里它最稳定,并且氢在那里附着。请注意,氢加成是第二步,与上面的例子不同。
加成反应
[edit | edit source]硼氢化
[edit | edit source]硼氢化是烯烃中非常有用的反应,与其说是最终产物,不如说是进一步反应的中间产物。我们将在下面讨论的主要反应是硼氢化/氧化反应,它实际上是一个硼氢化反应,然后是一个完全独立的氧化反应。

BH3 的加成是一个协同反应,因为几个键同时断裂和形成。硼氢化发生在所谓的顺式加成中,因为硼及其氢原子同时附着在烯烃的同一侧。正如您从图像中心过渡态中看到的那样,这会在两个烯烃碳原子以及硼及其氢原子之间产生一种盒子。在最后一步中,硼与其另外两个氢原子一起保持附着在其中一个碳原子上,而另一个氢原子则附着在相邻的碳原子上。
这种描述相当充分,但是反应实际上会继续发生,-BH2 会继续与其他烯烃反应生成 R2BH,然后再次反应,直到你最终得到硼原子附着在 3 个烷基上的络合物,即 R3B。
然后在其他反应中使用这种三烷基硼络合物来生成各种产物。
 |
 |
实际上,硼烷不能作为 BH3 稳定存在。在这种构型中,硼只有 6 个电子,而它需要 8 个电子,因此它在自然状态下实际上会形成左图所示的 B2H6 络合物。
此外,通常不用 B2H6 本身,而是用右图所示的与四氢呋喃 (THF) 形成的络合物形式的 BH3。无论哪种情况,反应的结果都是一样的。
硼氢化/氧化
[edit | edit source]
使用试剂二硼烷,(BH3)2,烯烃发生硼氢化生成烷基硼烷,R3B,在氧化后生成醇。反应过程简单方便,产率极高,产物是其他方法难以从烯烃中获得的产物。
二硼烷是假设的 BH3(硼烷)的二聚体,在我们关注的反应中,其作用类似于 BH3。事实上,在四氢呋喃(用于硼氢化的溶剂之一)中,试剂以单体形式存在,以与溶剂形成酸碱络合物。
硼氢化涉及 BH3(或后续阶段中的 BH2R 和 BHR2)与双键的加成,其中氢附着在一个双键碳原子上,而硼附着在另一个碳原子上。然后烷基硼烷可以发生氧化,其中硼被 -OH 取代。
因此,硼氢化-氧化的两步反应过程实际上允许在碳-碳双键上加成 H-OH 元素。
反应在醚中进行,通常是四氢呋喃或“二甘醇二甲醚”(二甘醇二甲醚,CH3OCH2CH2OCH2CH2OCH3)。二硼烷在四氢呋喃溶液中市售。烷基硼烷未分离出来,而是直接用碱性过氧化氢原位处理。
然后,硼氢化-氧化将烯烃转化为醇。加成具有高度的区域选择性;然而,这里的主要产物与氧汞化-去汞化或直接酸催化的水合反应形成的产物完全相反。
硼氢化-氧化过程生成与反马氏规则加成水到碳-碳双键相对应的产物。
3,3-二甲基-1-丁烯的反应说明了该方法的一个特殊优势。显然,在硼氢化过程中不会发生重排,因为碳正离子不是中间体,因此该方法可以在没有经常伴随着其他加成反应的复杂性的情况下使用。1,2-二甲基环戊烯的反应说明了合成的立体化学:硼氢化-氧化涉及整体顺式加成。

烯烃在水存在下与醋酸汞反应生成羟基汞化合物,这些化合物在还原后生成醇。
第一阶段,氧汞化,涉及-OH 和 -HgOAc 加成到碳-碳双键。然后,在还原中,-HgOAc 被 -H 取代。反应序列相当于烯烃的水合,但比直接水合具有更广泛的适用性。
氧汞化/还原是一个快速便捷的两步法过程,在温和条件下进行,并且通常能以超过 90% 的优异产率获得产物。在室温下,将烯烃添加到四氢呋喃溶剂稀释的醋酸汞水溶液中。反应通常在几分钟内完成。有机汞化合物不分离,而是原位用硼氢化钠 NaBH4 还原。(汞以元素汞球的形式回收。)
氧汞化/还原具有高度的区域选择性,生成与水按马氏规则加成到碳-碳双键相对应的醇。
氧汞化涉及亲电加成到碳-碳双键,其中汞离子作为亲电试剂。氧汞化步骤中不存在重排以及高度的立体专一性(通常是反式)表明开放碳正离子不是中间体。相反,有人提出,形成了类似于卤素加成中涉及的溴鎓离子和氯鎓离子的环状汞鎓离子。1971 年,奥拉报道了制备此类汞鎓离子的稳定溶液的光谱证据。
汞鎓离子被亲核溶剂水攻击,在本例中生成加成产物。这种攻击是背面攻击(除非被某些结构特征阻止),净结果是反式加成,就像卤素加成一样。因此,攻击属于 SN2 类型;然而,加成的取向表明亲核试剂连接到取代度更高的碳上,就好像存在一个自由的碳正离子中间体一样。正如我们将看到的,这种不稳定的三元环反应的过渡态具有很高的 SN1 特征。
还原通常不是立体专一的,在某些特殊情况下,可能伴随着重排。
尽管第一阶段具有立体专一性,但总体过程一般而言不是立体专一的。重排可能会发生,但不常见。3,3-二甲基-1-丁烯的反应说明了典型中间体碳正离子不存在重排的情况。
狄尔斯-阿尔德反应是一种反应(具体来说是环加成反应),在共轭二烯和取代的烯烃(通常称为亲二烯体)之间进行,形成取代的环己烯体系。即使新形成的环中的一些原子不是碳,该反应也可以进行。一些狄尔斯-阿尔德反应是可逆的;环状体系的分解反应被称为逆狄尔斯-阿尔德反应。

狄尔斯-阿尔德反应通常被认为是有机化学中更有用的反应之一,因为它只需要很少的能量就能生成环己烯环,这在许多其他有机反应中很有用。
几乎可以肯定地涉及协同的单步机制;两个新的碳-碳键在同一个过渡态中部分形成,尽管不一定形成程度相同。狄尔斯-阿尔德反应是环加成的最重要例子。由于反应涉及一个 4 π 电子体系(二烯)和一个 2 π 电子体系(亲二烯体),因此被称为 [4 + 2] 环加成。
烯烃的催化加氢生成相应的烷烃。该反应在压力下,在金属催化剂存在下进行。常见的工业催化剂是基于铂、镍或钯,但在实验室合成中,雷尼镍(由镍和铝的合金制成)经常被使用。
乙烯催化加氢生成乙烷的过程如下
- CH2=CH2 + H2 + 催化剂 → CH3-CH3
大多数烯烃加成反应遵循亲电加成机制。一个例子是普林斯反应,其中亲电试剂是羰基。
在有机溶剂存在下,将元素溴或氯加成到烯烃分别生成邻二溴烷烃和邻二氯烷烃。
溴水溶液褪色是检测烯烃存在的一种分析方法:CH2=CH2 + Br2 → BrCH2-CH2Br
该反应之所以有效,是因为双键处的电子密度高,导致 Br-Br 键中的电子暂时移动,从而产生暂时的感应偶极。这使得最靠近双键的 Br 稍微带正电,因此成为亲电试剂。
将卤代烃酸(如 HCl 或 HBr)加成到烯烃生成相应的卤代烷烃。
- 这种类型的反应的一个例子是:CH3CH=CH2 + HBr → CH3-CHBr-CH3
如果双键处的两个碳原子连接到不同数量的氢原子,则卤素优先存在于氢取代基较少的碳原子上(马氏规则)。
加成卡宾或类卡宾生成相应的环丙烷
烯烃被大量的氧化剂氧化。在氧气存在下,烯烃燃烧产生明亮的火焰,生成二氧化碳和水。用氧气催化氧化或与过酸反应生成环氧化合物。
在臭氧化反应中与臭氧反应导致双键断裂,生成两种醛或酮:R1-CH=CH-R2 + O3 → R1-CHO + R2-CHO + H2O
该反应可用于确定未知烯烃中双键的位置。
烯烃的聚合反应是一种经济上重要的反应,它生成具有高工业价值的聚合物,如塑料聚乙烯和聚丙烯。聚合反应可以通过自由基机制或离子机制进行。
亲核取代反应(SN1 和 SN2)与E1 和 E2 消除反应(在本节后面讨论)密切相关,通常最好一起学习这些反应,因为它们在反应机理、优选底物方面存在相似之处,而且这些反应有时会相互竞争。
重要的是要理解,取代和消除反应与特定化合物或混合物无关,而是对某些反应发生的表示。有时,这些机制的组合可能在同一反应中一起发生,或者可能相互竞争,溶剂或亲核试剂的选择等影响因素决定了哪个反应占主导地位。
注意在符号 SN1 和 SN2 中,
|
在亲核取代反应中,一个亲核试剂会攻击一个分子,取代另一个亲核试剂,而另一个亲核试剂则会离开。离开的亲核试剂被称为离去基团。
亲核取代反应需要
- 一个亲核试剂(例如路易斯碱)
- 一个带有离去基团的亲电试剂
一个离去基团是一个带电荷或中性的部分(基团),它会断裂分离。
SN1 和SN2之间的主要区别之一是SN1反应是一个两步反应,由离去基团的解离引发。另一方面,SN2反应是一个一步反应,其中进攻的亲核试剂由于其对碳的更高亲和力和更强的键合,迫使离去基团离开。这两件事在一个步骤中发生。
这两种不同的机理解释了SN1 和SN2反应之间反应速率的差异。SN1反应取决于离去基团从碳上的解离。它是速率控制步骤,因此反应速率是一级反应,其速率仅取决于该步骤。
另一方面,在SN2反应中,亲核试剂从离去基团的相反方向与反应物结合在一起的单一步骤是其速率的关键。因此,速率取决于亲核试剂的浓度和反应物的浓度。这两个浓度越高,碰撞越频繁。因此反应速率是二级反应
- (其中Nu:是进攻的亲核试剂)
主要有三个因素影响SN2反应是否会发生。最重要的因素是结构。即烷基卤代物是在甲基、伯碳、仲碳还是叔碳上。另外两个决定SN2反应是否会发生的因素是亲核试剂的亲核性以及反应中使用的溶剂。
SN2反应的结构反应活性CH3X > RCH2X > R2CHX >> R3CX |
烷基卤代物的结构对机理有很大影响。CH3X和RCH2X是SN2反应的首选结构。R2CHX可以在适当条件下(见下文)进行SN2反应,而R3CX很少参与SN2反应,甚至完全不参与。

该反应通过亲核试剂从溴原子相反方向进攻而发生。注意其他三个键都指向远离溴的方向,并指向进攻的亲核试剂。当这三个键是氢键时,接近的亲核试剂几乎没有空间位阻。然而,随着R基团数量的增加,空间位阻也随之增加,使亲核试剂更难接近α-碳,以排出溴原子。事实上,叔碳(R3CX)的空间位阻如此之大,以至于完全阻止了SN2机理的发生。
在这个例子中,一个仲α-碳,仍然存在很大的空间位阻,SN2机理是否会发生完全取决于亲核试剂和溶剂是什么。SN2反应优先发生在甲基卤化物和伯卤化物中。
另一个需要牢记的重要点是,这在上面的例子中可以清楚地看到,在SN2反应过程中,分子会发生翻转。当亲核试剂接近时,与α-碳相连的键会被推开。在过渡态期间,这些键与碳共平面,并且随着溴的离开和亲核试剂与α-碳键合,其他键会从亲核试剂处折叠回来。这在手性或前手性分子中尤为重要,其中R构型将被转换为S构型,反之亦然。正如你将在下面看到的那样,这与SN1反应的结果形成对比。
例子
- OH- + CH3—Cl → HO—CH3 + Cl-
OH-是亲核试剂,Cl是亲电试剂,HOCH3是产物,Cl-是离去基团。
或者,
- Na+I- + CH3-Br → I-CH3 + Na+Br-
上述反应在丙酮作为溶剂的情况下发生,钠和碘在丙酮中几乎完全解离,留下碘离子可以自由地攻击CH-Br分子。带负电荷的碘离子(亲核试剂)攻击溴甲烷分子,迫使带负电荷的溴离子离开并取而代之。溴离子是离去基团。
亲核性是亲核试剂在反应中取代离去基团的速率。通常,亲核试剂越大、越极化、越不稳定,其亲核性越强。没有使用特定的数字或计量单位。在其他条件相同的情况下,通常根据相对反应活性来比较亲核试剂。例如,一个特定的强亲核试剂的相对反应活性可能是一个特定弱亲核试剂的10,000倍。这些关系是概括性的,因为溶剂和底物等因素会影响相对速率,但它们通常是哪些物质成为最佳亲核试剂的良好指南。
所有亲核试剂都是路易斯碱。在SN2反应中,首选的亲核试剂是强亲核试剂,同时也是弱碱。例如N3-、RS-、I-、Br-和CN-。
另一方面,强亲核试剂同时也是强碱也可以起作用。然而,正如文本前面提到的,反应机理有时会相互竞争,对于强亲核试剂同时也是强碱的情况,SN2机理会与E2机理竞争。强亲核试剂同时也是强碱的例子包括RO-和OH-。
亲核性下降列表I- > Br- > Cl- >> F- > -SeH > -OH > H2O |
离去基团是底物上离开的基团。在烷基卤代物的情况下,这是当亲核试剂进攻时离开碳原子的卤离子。亲核试剂离开的趋势是
离去基团的相对反应活性I- > Br- > Cl- >> F- |
氟离子是非常差的离去基团,因为它们与碳原子结合得很牢固,很少用于烷基卤代物取代反应。离去基团的反应活性与其碱性有关,碱性越强,离去基团越差。
溶剂在SN2反应中起着重要作用,特别是在涉及仲烷基卤代物底物的SN2反应中,溶剂可以成为决定反应机理的因素。溶剂还可以极大地影响SN2反应的反应速率。
当溶剂是无质子、极性溶剂时,SN2机理是首选。也就是说,溶剂是极性的,但不含极性氢。极性质子溶剂包括水、醇,以及通常具有极性NH或OH键的溶剂。良好的无质子极性溶剂包括HMPA、CH3CN、DMSO和DMF.
首选极性溶剂,因为它能更好地使卤化物从烷基中解离。然而,具有极性氢的质子溶剂会在亲核试剂周围形成一个由氢键连接的溶剂“笼”,阻碍它接近底物。
溶剂的相对反应活性HMPA > CH3CN > DMF > DMSO >> H2O |
SN1机理与SN2机理有很大不同。在某些方面,它正好相反,并且在某些情况下,反应的结果可能会有很大差异。
与SN2 机制类似,结构在SN1 机制中起着重要作用。然而,结构在SN1 机制中的作用截然不同,因此结构的反应性或多或少是相反的。
SN1 的结构反应性CH3X < RCH2X << R2CHX < R3CX |
SN1 机制更适合叔卤代烷烃,并且根据溶剂的不同,可能更适合仲卤代烷烃。SN1 机制不适用于伯卤代烷烃或甲基卤代烷烃。要理解其中的原因,让我们看看SN1 机制是如何运作的。

在图的顶部,第一步是卤化物从卤代烷烃中自发解离。与SN2 机制不同的是,SN2 机制中进攻的亲核试剂导致卤化物离去,而SN1 机制则依赖于卤化物自身离去的能力。这需要一定的条件。特别是,碳正离子 的稳定性对于卤化物离去的能力至关重要。由于我们知道叔碳正离子是最稳定的,因此它们是SN1 机制最好的候选者。在适当的条件下,仲碳正离子也会通过SN1 机制进行反应。然而,伯碳正离子和甲基碳正离子不够稳定,无法使这种机制发生。
一旦卤化物解离,水就会充当亲核试剂与碳正离子键合。在SN2 反应中,由于亲核试剂从卤化物仍然与碳键合的相反一侧进攻,因此会发生反转。在SN1 机制中,由于卤化物已经离去,并且α-碳上的键已变成平面,因此水分子可以从任一侧进攻。这主要导致生成外消旋混合物。在最后一步,与水分子键合的水分子的一个氢原子被另一个水分子进攻,留下一个醇。
注意:外消旋混合物意味着混合物完全等量,但这种情况在SN1 中很少见。从卤化物离去一侧的相反一侧进攻的趋势略微明显。这是因为卤化物离去后,有时离去的卤化物离离去的一侧足够近,会阻碍亲核试剂从那一侧接近。
溶剂
[edit | edit source]与SN2 机制类似,SN1 也会受到溶剂的影响。然而,与结构一样,原因也不同。在SN1 机制中,使用极性、质子溶剂。溶剂的极性与溶剂的介电常数有关,介电常数高的溶液更有利于支持溶液中分离的离子。在SN2 反应中,我们关注的是极性氢原子“笼罩”我们的亲核试剂。在SN1 反应中,使用极性质子溶剂时也会发生这种情况,那么为什么我们不担心呢?你必须记住反应的机理。SN1 反应的第一步,更重要的是限速步骤,是通过使卤化物阴离子离去来生成稳定碳正离子的能力。对于极性质子溶剂,与极性非质子溶剂一样,我们正在生成稳定的阳离子,但是是极性氢原子稳定了卤化物阴离子,使其更容易离去。改善限速步骤始终是目标。亲核试剂的“笼罩”与限速步骤无关,即使处于“笼罩”状态,第二步,亲核试剂的进攻,比第一步快得多,以至于可以忽略“笼罩”。
总结
[edit | edit source]SN1、SN2、E1 和 E2 都是反应机理,而不是反应本身。它们是许多不同反应使用的机理。在有机化学中,目标通常是合成产物。在可能存在竞争机理的情况下,特别是SN1 和 E1 反应竞争的情况下,主要的机理将决定你的产物是什么,因此了解机理以及哪些条件有利于一个机理而不是另一个机理,将决定你的产物。
在其他情况下,了解机理可以让你建立有利于该机理的环境。这可能意味着你的产物在几分钟内产生,或者在下一个冰河时代产生。
因此,当你设计一个产物的合成方法时,你需要考虑,我想得到产物 Y,那么我有哪些方法可以得到 Y?一旦你了解了你的选择,并且你决定了反应,那么你需要考虑反应的机理,并问问自己,如何创造条件使反应正确快速地发生?
消除反应
[edit | edit source]亲核取代反应和消除反应有很多共同的特征,除此之外,E1 和 SN1 以及 E2 和 SN2 反应有时会竞争,由于它们的产物不同,因此理解它们两者都很重要。如果不理解这两种机理,就很难从反应中得到你想要的产物。
此外,SN1 和 SN2 反应将在比较和对比中被多次引用,因此最好先阅读该部分,然后继续阅读。
消除反应是将 卤代烷 反应物生成烯烃产物的机理。E1 和 E2 消除反应与 SN1 和 SN2 取代反应不同,它们不会发生在甲基卤代烷烃上,因为反应会在两个碳原子之间形成双键,而甲基卤代烷烃只有一个碳原子。
注意在符号 E1 和 E2 中,
|
E1 与 E2
[edit | edit source]反应速率
[edit | edit source]E1 和 E2 是两种从卤代烷烃生成烯烃的不同途径。与 SN1 和 SN2 反应一样,主要区别之一在于反应速率,因为它提供了对机理的深刻见解。
E1 反应,与 SN1 反应一样,是两步反应。同样与 SN1 反应一样,限速步骤是卤化物从烷烃中解离,使其成为一级反应,取决于卤代烷烃的浓度,反应速率为
另一方面,E2 反应,与 SN2 反应一样,是一步反应。同样,与 SN2 反应一样,限速步骤是亲核试剂附着在烷烃上并置换卤化物的能力。因此它是一个二级反应,取决于亲核试剂和卤代烷烃的浓度,反应速率为
- (其中Nu:是进攻的亲核试剂)
扎伊采夫规则
[edit | edit source]扎伊采夫规则(有时拼写为“Saytzeff”)指出,在消除反应中,当多个产物可能存在时,最稳定的烯烃是主要产物。也就是说,取代度最高的烯烃(具有最多非氢取代基的烯烃)是主要产物。
E1 和 E2 反应都会产生混合产物(如果可能的话),但通常遵循扎伊采夫规则。我们将看到,E1 反应更可靠地遵循扎伊采夫规则,并且往往会产生更纯的产物。

上图表示了(S)-2-溴-3-甲基丁烷脱卤化氢的两种可能的途径。两种潜在的产物是2-甲基丁-2-烯和3-甲基丁-1-烯。右侧的图像是对中心图像中显示的分子产物的简化绘图。
如左图所示,溴原子位于第二个碳原子上。在 **E1** 或 **E2** 反应中,氢原子可以从第一个或第三个碳原子上脱落。扎伊采夫规则指出,氢原子主要从第三个碳原子上脱落。实际上,会得到混合物,但大部分产物将通过 **E1** 机制得到 2-甲基丁-2-烯。通过 **E2** 反应,正如我们稍后将看到的,情况可能并非如此。
E2 结构对反应性的影响RCH2X > R2CHX >> R3CX |
**E2** 机制是一个协同且高度立体专一的反应,因为只有当 H 和离去基团 X 处于反式共平面位置时,该反应才能发生。也就是说,在纽曼投影中,H 和 X 必须相隔 180°,或处于反式构型。这种现象源于当形成 π 键时,相邻碳原子的 2 *p* 轨道之间的最佳重叠。如果由于分子的结构,H 和离去基团无法处于这种位置,则 **E2** 机制将不会发生。

因此,只有具有可达到的 H-X 反式共平面构象的分子才能通过这条途径发生反应。此外,如果离去基团的唯一反式共平面氢原子导致生成最不稳定的烯烃,则 **E2** 机制将违反扎伊采夫规则。一个很好的例子是观察环己烷和环己烯衍生物如何在 **E2** 条件下发生反应。

让我们看一下上面的例子。我们使用的反应物是 1-氯-2-异丙基环己烷。左上角的图是其中一种构象,下面的图是在环翻转之后的构象。中间是两种构象的纽曼投影,右边是产物。
如果我们假设用强碱,例如 CH3CH2O-(乙醇盐)处理 1-氯-2-异丙基环己烷,那么主要的反应机制是 **E2**。在氯原子相邻的碳原子上,有 3 个氢原子。红色和绿色的是其中两个。第三个很难显示出来,但它与红色氢原子连接在同一个碳原子上,从平面稍微向下倾斜,朝向观察者。红色氢原子是唯一与氯原子相隔 180° 的氢原子,因此它是唯一符合 **E2** 机制的氢原子。因此,产物将只有 3-异丙基环己-1-烯。注意,这与扎伊采夫规则相反,扎伊采夫规则指出,取代程度最高的烯烃是优先的。根据他的规则,1-异丙基环己烯应该是我们的主要产物,因为这样会留下取代程度最高的烯烃。然而,由于空间位阻,它根本无法生成。
下面的图像显示了环翻转后的分子。在这种构象中,无法生成产物。从纽曼投影中可以看出,没有氢原子与氯原子相隔 180°。
因此,在考虑 **E2** 机制时,理解分子的几何形状很重要。有时,几何形状可以用来帮助优先得到单一产物。其他时候,它会阻止你得到你想要的产物,你需要考虑另一种机制来获得你的产物。
注意:通常用 **近平面** 一词代替 **共平面**。**共平面** 意味着精确的 180 度分离,而 “peri-” 来自希腊语,意思是 “附近”,意味着接近 180 度。近平面实际上可能更准确。在 1-氯-3-异丙基环己烷的例子中,由于分子力的作用,氯原子实际上与氢原子和异丙基都略小于 180 度,所以在这种情况下,**近平面** 可能是更准确的术语。

**E1** 机制从离去基团从烷基上解离开始,在烷基上产生一个碳正离子,并留下一个阴离子。这与 **SN1** 反应开始的方式相同,因此有利于 **SN1** 反应中帮助启动该步骤的因素,也有利于 **E1** 反应中启动该步骤的因素。更具体地说,二级和三级碳正离子是首选,因为它们比一级碳正离子更稳定。溶剂的选择与 **SN1** 相同;首选极性质子溶剂,因为极性方面稳定碳正离子,质子方面稳定阴离子。
那么,决定反应是走 **SN1** 途径还是 **E1** 途径的差异,必须取决于第二步;亲核试剂的作用。在 **SN1** 反应中,首选强亲核试剂,它也是弱碱。然后,亲核试剂会进攻并与碳正离子键合。在 **E1** 反应中,仍然首选强亲核试剂。不同的是,强亲核试剂,也是强碱,会导致亲核试剂攻击 β-碳上的氢原子,而不是 α-碳正离子。然后,亲核试剂/碱会夺取氢原子,使键合电子落入并与碳正离子形成 π 键。
由于氢原子和离去基团在两个独立的步骤中丢失,并且对几何形状没有要求,因此 **E1** 机制更可靠地产生符合扎伊采夫规则的产物。


![{\displaystyle Rate=k[RX]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/324f51c64b519398368c73c66efe9b5d53d44598)
![{\displaystyle Rate=k[Nu:][RX]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a9af6c4ef48c9f511b28f0e657d92661dd388f5)