结构生物化学/有机化学/有机官能团/羟基
羟基是有机化学中研究的众多官能团之一。羟基的存在表明该分子要么是醇要么是羧酸。羟基的化学表示为–OH,表示氧原子共价键合到氢原子。
在醇的一般官能团中,有三个亚组:伯醇、仲醇和叔醇。醇根据它所连接的碳原子进行分类,伯醇、仲醇或叔醇。如果醇连接到只有一个碳-碳键的碳原子,则该醇为伯醇。同样地,如果醇连接的碳原子与另外两个碳原子相连,则该醇为仲醇,如果碳原子剩余的三个键与其他碳原子相连,则该醇为叔醇。以下分别是伯醇、仲醇和叔醇的例子:乙醇、异丙醇(IUPAC 命名法:丙-2-醇)和叔丁醇(IUPAC 命名法:2-甲基丙-2-醇)。
 |
 |
氧和氢之间存在的键明显短于碳和氢之间形成的键。羟基本质上是极性的。共价键中的氧原子具有很高的电负性;因此,它将共价键中共享的大部分电子密度拉向自身。从这些信息可以清楚地看出,氧原子带有明显的负偏电荷,而氢原子则带有相同大小的正偏电荷。
极性基团的存在使得醇能够与其他分子形成氢键。例如,在乙醇中,一个乙醇分子上的带负电的氧原子被吸引到另一个乙醇分子上的带正电的氢分子。醇之间能够形成氢键解释了它们的熔点较高。醇的沸点也高于含有相当数量碳原子的烃类和醚类。
醇在水中的溶解度很有趣,因为醇具有疏水和亲水中心,使其成为两亲性物质或两亲性物质。醇的烃部分是非极性的,因此抵抗在水中的溶解;极性醇基团是亲水的,因此促进在水中的溶解。在丙醇这样的小分子中,醇会溶解,因为极性醇基团的重量超过了非常短的氢链。然而,随着烃链从丁醇增加到戊醇和己醇,醇在水中的溶解度变得几乎不可混溶。
醇是两性物质,既可以作为酸也可以作为碱存在。在低 pH 值或被强酸包围时,它们可以被质子化成烷氧鎓离子。相反,在高 pH 值下,以及被强碱包围时,它们可以以烷氧负离子形式存在。
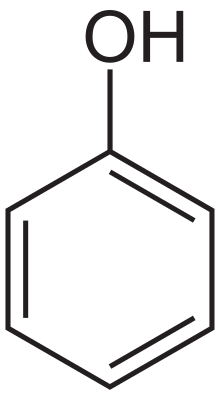
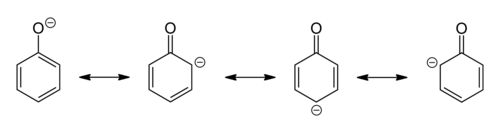
酚是羟基芳烃。它们在氧原子的化学反应性方面与醇有一些相似之处,但它们的酸性更强,碱性更弱。它们似乎是烯醇(羟基连接到烯烃上)并且应该比酮式不稳定,但芳香性的增加使它们处于烯醇式比酮式更稳定。对共振形式的检查表明,羟基将电子密度捐献给环,因此羟基是活化基团,并且是邻位-对位定位基团。 
取代酚被命名为母体化合物苯酚的衍生物,其中带有羟基的碳原子被指定为 C-1。一些例子是
| 2-甲基-4,6-二硝基苯酚 | 苯-1,3-二醇 |
|---|---|
 |

|
酚的 pKa 值约为 8-10。酚的酸性比醇强得多。这是因为苯酚负离子(相应的共轭碱)是共振稳定的。
无法直接协同取代芳香环上的离去基团。在适当取代的环中,离去基团可以通过亲核过程通过两步机制被羟基取代:亲核芳香取代反应。
酚会发生与醇相同的许多反应,特别是在涉及相应苯酚负离子(烷氧负离子)的亲核性时。
在工业上,甲醇是以数十亿磅的规模从称为合成气的 CO 和 H2 的加压混合物中制成的。该反应涉及由铜、氧化锌和氧化铬 (III) 组成的催化剂。
将催化剂改为铑或钌会导致 1,2-乙二醇(乙二醇)的生成,这是一种重要的工业化学品,是汽车防冻剂的主要成分。乙醇通过糖的发酵或通过磷酸催化的乙烯(乙烯)水合反应以大量制备。
在比工业规模小的范围内,我们可以从各种各样的起始原料制备醇。例如,通过特征性地使用氢氧化物和水的 Sn2 和 Sn1 过程,将卤代烷转化为醇。然而,这些方法的使用并不像人们想象的那样广泛,因为所需的卤代烷通常只能从相应的醇中获得。它们还存在亲核取代反应的通常缺点:在受阻体系中,双分子消除反应可能成为主要的副反应,而叔卤代烷会形成可能发生 E1 反应的碳正离子。一些这些缺点通过使用极性非质子溶剂来克服。
从概念上讲,减少羰基的最简单方法是直接在碳氧双键上添加氢,H-H。虽然可以做到这一点,但这需要高压和特殊的催化剂。更方便的方法是极性过程,其中氢负离子和质子同时或依次传递到双键。
有机金属试剂
[edit | edit source]镁和锂的有机金属试剂用于合成醇。由于有机金属化合物中的金属极具正电性,碳可以表现出带负电荷的反应(赋予其亲核行为)。这些有机金属化合物可以攻击醛和酮的羰基。该反应的一个重要特征是在该过程中形成了新的碳碳键。[1]

该反应的第一步涉及亲核碳攻击酮或醛的羰基碳以形成碳碳键。同时,来自碳氧双键(羰基)的两个电子被来自攻击碳的电子推开,形成金属醇盐与有机金属化合物中的金属。经过水性处理后,通过水解金属醇盐形成醇。[1]
通过改变与有机金属化合物反应的化合物,可以形成不同类型的醇。例如,有机金属化合物与甲醛的反应将生成伯醇。与任何其他类型的醛的反应将生成仲醇;与酮的反应将生成叔醇。[1]
羟基化
[edit | edit source]代谢降解的一个重要功能是在我们身体中未功能化的分子部分引入羟基(羟基化)。一组被称为细胞色素蛋白的蛋白质是几乎所有活细胞中都存在的至关重要的生物分子,它们帮助羟基化过程。细胞色素 P-450 是细胞色素蛋白的一个例子。细胞色素 P-450 使用 O2 将羟基添加到烷基取代基中。羟基化的重要性可以通过排泄药物来防止毒性积累来体现。羟基化通过在化合物的特定区域添加羟基来帮助提高化合物的水溶性。因此,在肝脏中,羟基化有助于通过使其更易溶来加速我们摄入的药物的排泄。如果没有这个过程,摄入的药物会停留在我们体内的更长时间,并且有更大的机会积累毒性。 [1]
羟基化在将羟基添加到分子中也具有选择性。经历羟基化的蛋白质可以控制羟基添加的顺序,以及添加的位置。这是羟基化过程的关键功能,因为它允许分子在分子的特定区域发生氧化。它还允许分子以特定的方向与其他化合物结合或反应。 [1]
命名法
[edit | edit source]用于命名有机分子的系统 - IUPAC - 对醇来说相对容易使用,但如果含有醇基的分子包含含有其他官能团的取代基,例如烯烃、炔烃或卤素,则会变得更加复杂。最简单的情况是分子仅包含烃,羟基是唯一的官能团,使其纯粹为醇。
一般来说,官能团的存在由一个特征后缀表示,该后缀对每个官能团都是不同的,以及一个指定官能团在分子上的位置的数字。对于醇,使用的特征后缀是 -ol。
情况 1:烃和醇在这种情况下,烃的最长链被计数 - 这成为分子中主要烃链。然后对最长的碳链进行编号,目的是在羟基上放置尽可能小的数字。最长的链按烷烃的命名方式命名,但醇的后缀是 -ol。因此,含有在第二个碳上含有醇基的丙烷链被命名为丙-2-醇或 2-丙醇。由于醇是唯一的官能团,所以使用这两个名称中的哪一个并不重要。假设“2”对应于羟基的位置。但是,当存在其他官能团时,此规则并不总是成立。
情况 2:这更复杂,因为在有机化学中存在官能团的等级。每个官能团在孤立时都希望被标记为最小的数字。但是,一些官能团具有“更重要的意义”,因此首先被编号。此外,如果醇不再是最“重要的”官能团,则该分子不具有醇的后缀。这在最初可能会出现一个小问题,因为 -ol 是该分子具有 -OH 基团的唯一提示。但是,-OH 基团的存在通过在与 -OH 基团键合的碳的数字之后使用“羟基”一词来表示。例如:1-氯-2-羟基苯。
如果存在多个 -OH 基团,则命名法仅略有修改。名称中使用的后缀是醇基数目,后跟 -ol。例如,含有两个 -OH 基团的化合物具有“二醇”后缀;对于含有三个 -OH 基团的化合物,后缀是“三醇”。包含醇基的碳的数字以与只有一个醇基相同的方式表示;使羟基具有尽可能低的数字。例如,二醇将被命名为 3,3 戊二醇。此名称表明五碳链中的第三个碳与两个 -OH 基团键合。
醇和酚的独特红外光谱
[edit | edit source]红外光谱是化学家用来阐明有机化合物结构信息的技巧。有机分子在红外区域吸收电磁辐射并促进特定的振动状态。这些振动被称为基频吸收,它们是由从基态激发到最低能量激发态引起的。这些振动模式然后被机器拾取,该机器以光谱的形式解释辐射。由于每种类型的共价键具有不同的自然振动频率,因此两种不同的分子永远不会共享相同的光谱。某些键的吸收具有非常独特的振动频率。一小部分吸收可以分配给特定类型的键。例如,大约 1715 的吸收通常是由于羰基引起的。
醇和酚具有独特的红外光谱,通常在 3400 和 3300 cm−1 之间显示出强而宽的拉伸带。在溶液中,有时可以观察到大约 3600−1 处有一个自由拉伸带,具有尖锐但较弱的峰。
众所周知的醇或酚峰是由 O-H 之间的拉伸振动产生的。分子间氢键通常会削弱 O-H 键,并将该带移到较低的频率。已知酚比醇具有更宽的 O-H 带。然而,由于它们的形状相似,很难通过观察 O-H 带来确定差异。C-O-H 之间的弯曲振动通常在 1440–1220 cm−1 处产生弱而宽的峰。然而,这些峰由于强 CH3 弯曲峰的类似带的干扰而难以看到。从 1260 – 1000 cm−1 观察到强烈的 C-O 键拉伸。由于 C-O 键与 C-C 键相邻,因此峰的形状和大小可用于确定醇是伯醇、仲醇还是叔醇。它还可用于区分酚和醇。此外,在酰胺、醚和醛中存在的醇也可以在红外光谱中区分。红外光谱是一种有用的分析工具,用于识别哪些官能团存在或哪些官能团不存在。
醇基的核磁共振
[edit | edit source]核磁共振 (NMR) 是一种用于识别有机化合物的技术。由于原子核由于带正电的质子而具有自旋电荷,因此它可以产生磁场。正因为如此,质子将具有两种方向,即 β 和 α 自旋态,它们在存在外部磁场的情况下具有不同的能量。当化合物暴露于电磁辐射时,会发生共振(当原子核在方向之间来回翻转时),当辐射量与两种自旋态的能量差相匹配时,会记录 NMR 信号,NMR 检测器会记录峰。
核磁共振 (NMR) 最常见的形式之一是质子核磁共振 (H+ NMR)。NMR 谱图通过不同基团的化学位移来解读。在质子 NMR 中,含有 -OH 基团的化合物在约 0.5-5.0 ppm 处会有化学位移(峰)。例如,乙醇在约 4.0 ppm 处会有一个峰,表示羟基,而其在约 1.0 ppm 和约 3.0 ppm 处的另外两个峰则表示 C-H 质子的位置,这与它们在化合物中的位置有关。
1. Schore, Neil E. (2011). 有机化学结构与功能 第 6 版. W. H. Freeman.
2. Hammond, Christina N., Mohrig, Jerry R., Schatz, Paul F.. (2010). 有机化学实验技术 第 3 版. W.H. Freeman.
3. Atkins, Peter, Jones, Loretta. (2008). 化学原理:探索洞察 第 4 版. W. H. Freeman.