结构生物化学/化学键/氢键
氢键是由偶极-偶极力形成的,这种力存在于一个电负性原子(氢键受体)和一个与另一个相同分子或不同分子的电负性原子(氢键供体)共价结合的氢原子之间。只有氮、氧和氟原子可以与氢相互作用形成氢键供体;这与氢共价键不同。然而,氢键受体可以是任何参与极性键、具有电负性和具有孤对电子的原子。在氢键中,氧、氮或氟上的孤对电子与共价键合到这些原子之一的部分正电荷的氢相互作用。氢键中的氢原子由两个电负性原子(如氧或氮)共享。)氢键负责DNA双螺旋结构中特定的碱基配对,并且是DNA双螺旋结构稳定性的主要因素。氢键供体包括氢原子和与其最紧密结合的原子。氢键在蛋白质的结构中也起着非常重要的作用,因为它稳定了由α螺旋、β折叠、转角和环形成的蛋白质的二级、三级和四级结构。氢键连接了蛋白质结构中不同多肽链之间的氨基酸。氢键受体是与氢原子结合较弱的原子。
氢键从根本上说是静电相互作用,并且比共价键弱得多。然而,它们是最强类型的偶极-偶极相互作用。氢原子所键合的电负性原子会将电子密度从氢原子处拉走,从而产生部分正电荷。因此,氢原子可以通过静电相互作用与部分带负电的原子相互作用。

氢键是静电相互作用的一种形式,发生在与两个电负性原子键合的氢原子之间;其中一个是氢键供体,在其自身与氢之间具有更强的键。这些电负性原子是氮、氧和氟;这种电负性原子会将电子密度从氢原子处拉走,使其带部分正电荷。这种部分正电荷被氢键受体(富电子密度原子)的部分负电荷吸引。氢键供体、氢原子和氢键受体之间形成的化学键具有直线形结构。
氢键(H键)是分子之间或分子内部的非共价键合类型,可以是分子间或分子内的。这种键合类型比共价键和离子键弱得多且长得多,但比范德华相互作用强。它也具有一些共价键的特点:直接且笔直。换句话说,H键供体和H键受体位于一条直线上。为了形成H键,需要H键供体和H键受体。H键供体是指其氢原子与具有可用价电子的高电负性小原子键合的分子(N、F和O最符合上述描述,因为它们非常电负性,使得与其共价结合的H非常正)。H-O、H-N和H-F键极性非常强;因此,电子密度很容易从氢原子处被拉向电负性原子。一个分子中的部分正电荷氢被另一个分子上电负性原子的部分负电荷孤对电子吸引,并且由于这种相互作用,H键形成。所有氢键的强度都各不相同。
关于氢键的其他重要事实如下。氮、氧和氟的小尺寸对于氢键至关重要,原因有两个。一个是它使这些原子具有电负性,使其共价键合的H高度为正。另一个原因是它允许另一个氧、氮或氟上的孤对电子靠近H。此外,氢键在许多系统中具有深远的影响。氢键也参与了许多酶的作用[物质和变化的分子性质]。
氨、水和氟化氢的沸点都高于其他类似的分子,这是由于氢键造成的。氢与这些强电负性原子之间的键极性很强,氢上带部分正电荷。这种部分正电荷氢强烈地被相邻分子上部分负电荷的氧吸引。一般来说,沸点随着分子量的增加而升高,这是因为额外的质量需要更高的温度才能使分子快速运动,并且因为较重的分子具有更大的伦敦力。水的凝固点也比其他类似的分子高得多。一个不寻常的特点是,当它冻结时,密度会降低。每个氧原子周围的四面体结构,有两个规则的氢键和两个与其他分子的键。这需要冰分子之间有很大的空间。笼形水合物是捕获在固体(如冰)孔洞中的分子,理论上可以被用作麻醉剂。
氢键对分子的沸点有显着影响。沸点通常随着摩尔质量的增加而增加。然而,参与分子间氢键键合的分子与摩尔质量相同但不参与氢键键合的分子相比,具有更高的沸点。这是因为异常强的氢键力允许水分子之间发生更强的相互作用,从而形成更强的键和更高的沸点。[1]此外,氢键是造成水的许多异常性质的原因,例如其高沸点、熔点、汽化热、高介电常数、表面张力、毛细作用等。
氢键可以在氢和另外四种元素之间发生。氧(最常见)、氟、氮和碳。碳是一种特殊情况,只有当它与非常电负性的元素(如氟和氯)结合时,它才会真正参与氢键。[1]
氢键是生物化学中三种主要大分子(如蛋白质、核酸和碳水化合物)的重要组成部分。氢键负责蛋白质(酶)的结构和性质。由于存在官能团,氢键适用于这些生物分子。其中一些是羧酸、醇甚至胺基团。它们可以提供氢、氧或氮用于可能的氢键。[1]

如前所述,氢键可以是分子间的(例如,水分子之间的键合),也可以是分子内的(例如,蛋白质和DNA的键合)。蛋白质的二级结构是由氨基酸之间的氢键形成的。例如,α-螺旋是一种棒状的二级结构,它是由于(i)个氨基酸的羧基与(i+4)个氨基酸的氨基之间形成氢键而产生的。转角(环家族)是一种二级结构,它是由(i)个氨基酸的羧基与(i+3)个氨基酸的氨基之间形成氢键而产生的。β-折叠是一种二级结构,它是由两个或多个β-链之间的氢键形成的。反平行β-链形成的氢键是直的,因为羰基和氨基直接对齐,而平行β-链形成的氢键则略微弱一些,因为羰基和氨基没有完美对齐,从而形成更长且更弱的氢键。
蛋白质在水中的溶解度取决于其与蛋白质表面形成氢键的能力。具有更大亲水表面含量的蛋白质通常更能够与周围的水形成氢键。溶液盐浓度的改变,如在盐析/盐溶中进行的那样,会产生一种屏蔽效应,从而降低了与水中氢形成氢键的能力。盐析蛋白质沉淀法在蛋白质分离中利用了这一概念。

氢键最简单的例子可以在水分子中找到。水分子由一个氧原子连接到两个氢原子组成。两个水分子之间可以形成氢键。在存在许多水分子液态水中,每个水分子都可能与多达4个其他分子形成氢键(2个通过其2个氢原子,每个氢原子与另一个氧原子形成氢键,另外2个通过其氧原子上的2个孤对电子,可以与另外2个氢原子形成氢键)。
尽管水分子量低,但它具有异常高的沸点。这种特性可以归因于水内部存在大量的氢键。由于这些键难以断裂,因此与其他类似但缺乏氢键的液体相比,水的熔点、粘度和沸点都相对较高。与某些也具有氢键的其他液体相比,水包含大量氢键(最多4个)。一个例子是氨,其中氮只有一个孤对电子但有3个氢原子,因此最多只能形成2个氢键。
氢键还可以解释为什么冰的密度小于液态水的密度。在水的液态形式中,使分子紧密结合在一起的氢键在室温下不断断裂和重新形成。但当水变成冰时,氢键导致水分子形成刚性晶格结构,这会导致分子之间出现较大的间隙,从而导致其密度较小但体积较大。
氢键也解释了水的表面张力高的原因。水分子之间大量氢键的可用性(每个水分子有4个氢键)证明了它们彼此粘附得多么好,形成了一个强大而有弹性的表面。可以观察到此特性的常见示例包括一个装满超过顶部但没有溢出的杯子,或者能够停留在水上而不破坏其表面的小型生物。
水根据温度的不同具有不同数量的氢键。据估计,在0°C时,每个水分子平均具有3.69个氢键,而在25°C时,它平均具有3.59个氢键,而在100°C时,它平均具有3.24个氢键。随着温度升高,氢键减少,这可以归因于分子运动的增加。
DNA包含四个碱基:鸟嘌呤、胞嘧啶、腺嘌呤和胸腺嘧啶。鸟嘌呤与胞嘧啶和腺嘌呤与胸腺嘧啶的互补碱基对利用氢键相互连接。这些互补核苷酸之间的氢键使DNA双螺旋的两个链保持在一起。每个碱基还可以与外部环境(例如水)形成氢键。尽管这些内部和外部氢键相当弱,但DNA中所有数百万个氢键的综合力量使其成为一个稳定的分子。此外,每个核苷酸上磷酸基团上的氢键相互作用,导致两条DNA链形成螺旋结构。
DNA中的碱基配对(一个嘌呤和一个嘧啶碱基)可以更详细地解释。除了将DNA链连接在一起外,互补碱基之间的氢键还将碱基隔离在双螺旋的内部。因此,碱基之间的氢键增强了稳定DNA的疏水作用。疏水碱基再次保留在螺旋的内部,而极性外部则接触溶剂水。氢键是一种弱的分子力,但它是一种稳定DNA分子的累加效应。碱基通过氢键精确地结合在一起,能量为1至5 kcal/mol(4至21 kJ/mol)。
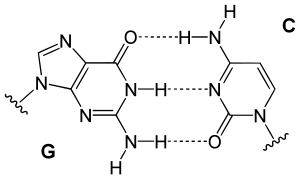
一个嘌呤(鸟嘌呤和腺嘌呤)和一个嘧啶(胞嘧啶和胸腺嘧啶)的DNA碱基中的氢键 tạo ra hình dạng tương tự。鸟嘌呤和胞嘧啶配对的形状和结构与腺嘌呤和胸腺嘧啶配对的形状和结构非常相似。胞嘧啶和鸟嘌呤通过三个氢键结合在一起。腺嘌呤和胸腺嘧啶配对共享两个氢键,因此键略微弱一些且略长一些。
 |
 |
Silberberg, Martin S. 化学“物质和变化的分子本质”。第五版。2009年。
Berg,Jeremy;Tymoczko,John;Stryer,Lubert。生物化学,第6版。W.H. Freeman and Company。2007年。(8) https://wikibooks.cn/wiki/Structural_Biochemistry/Chemical_Bonding/Dipole_interaction https://wikibooks.cn/wiki/Structural_Biochemistry/Nucleic_Acid/DNA https://wikibooks.cn/wiki/Structural_Biochemistry/Chemical_Bonding/Covalent_bonds https://wikibooks.cn/wiki/Structural_Biochemistry/Proteins https://wikibooks.cn/wiki/Structural_Biochemistry/Nucleic_Acid https://wikibooks.cn/wiki/Structural_Biochemistry/Carbohydrates https://wikibooks.cn/wiki/Structural_Biochemistry/Proteins/Structures https://wikibooks.cn/wiki/Structural_Biochemistry/Proteins/Amino_Acids https://wikibooks.cn/wiki/Structural_Biochemistry/Nucleic_Acid/Nitrogenous_Bases/Purines/Guanine https://wikibooks.cn/wiki/Structural_Biochemistry/Nucleic_Acid/Nitrogenous_Bases/Purines/Cytosine https://wikibooks.cn/wiki/Structural_Biochemistry/Nucleic_Acid/Nitrogenous_Bases/Purines/Adenine https://wikibooks.cn/wiki/Structural_Biochemistry/Nucleic_Acid/Nitrogenous_Bases/Purines/Thymine https://wikibooks.cn/wiki/Structural_Biochemistry/Water
