AP 化学/周期性
外观
< AP 化学
周期表本质上是许多信息的总结,这些信息作为参考很有用,并且对于 AP 化学考试至关重要。它看起来像这样
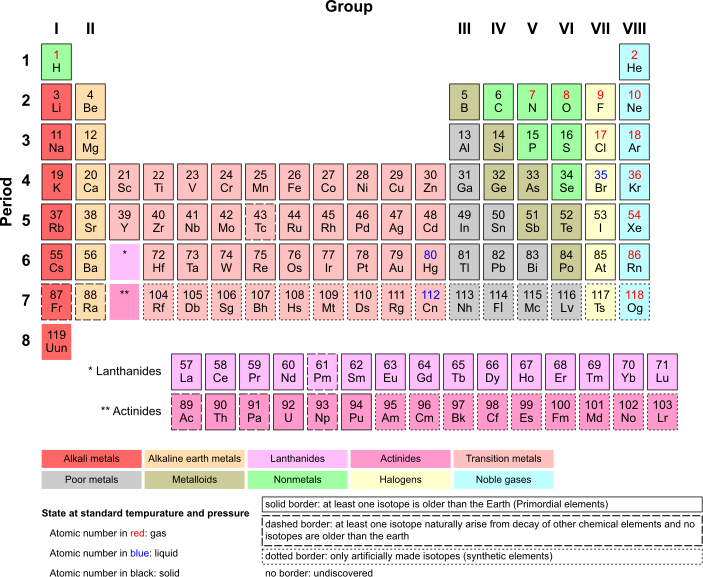
每一行称为周期,每一列称为族。同一族的元素往往具有相似的性质。请注意每一族元素的名称和位置(碱金属、碱土金属等),它们会被提及。每个方格代表一个元素。让我们看一下周期表中的一个方格

- 上面的一个小数字表示元素的原子序数。它也表示一个元素原子核中的质子数。
- 中间的两个大字母表示元素的缩写。这个元素是 He,或氦
- 大字母下方的小数字表示元素的原子量。元素的原子量是元素同位素的原子量的加权平均值,按元素的丰度加权(如果 He-4 占 97% 的时间,He-5 占 3% 的时间,那么你会做 .97 ⋅ 4 + .03 ⋅ 5,这就是原子量)。
通过找到质荷比来创建基于质量的光谱。用于确定同位素的重量。
当能量输入原子并且该电子被释放时,创建基于电子动能的光谱。
- 金属在周期表中向下和向左移动时往往更具反应性(称为金属特性)。
- 非金属在周期表中向上和向右移动时往往更具反应性(称为非金属特性)。
- 原子半径从上到下增加,从右到左也增加,因为有效核电荷减小。
- 第一电离能从上到下减小,从右到左也减小(与原子半径相反)。当从具有满壳层的元素中夺取电子时,电离能会特别高。
- 电子亲和力(原子想要接受电子的程度)越靠近 F 的原子越想要电子(负亲和力值),而越靠近 Fr 的元素不会接受电子(正亲和力值)。
- 电负性(电子对单个原子的吸引力)与电子亲和力具有相同的趋势。它用于确定电子如何在分子中的原子之间分布。
- 在 I-VIII 族中,每一族中的元素具有相同数量的价电子,使它们具有相似的性质。
- 形成阳离子(+ 离子)的原子往往较小,因为排斥力较小。阴离子(- 离子)往往较大,因为排斥力较大。
