AP 化学/基础
你应该记得高中化学课上的所有内容。
- AP 考试中不使用华氏度。使用摄氏度 (°C) 和开尔文 (K)。纯水在 0° 摄氏度 (273K) 结冰,在 100° 摄氏度 (373K) 沸腾。在 AP 考试中,开尔文可以通过添加 273.15 转换为摄氏度。
有效数字用于确保正确传达精度。当给出测量值时,最后一个数字被认为是 ±1。例如,数字 3.5 被认为在 3.4 到 3.6 之间,当没有给出精确精度时。
- 数字 1 到 9 是有效的,介于它们之间的零也是有效的。例如,数字 209 有三个有效数字。
- 所有其他数字右边的零只有在写有小数点时才有效。290 有 2 个有效数字,290. 有三个,290.0 有四个。
- 前导零无效。0.00209 只有三个有效数字。
精确值是定义值或计数结果。一打定义为 12 个物体。一磅定义为 16 盎司。精确值被认为具有无限个有效数字。相反,测量值总是像前面描述的那样具有有限个有效数字。报告为 12 克的质量意味着已知到最接近的克,而不是到十分之一克。
12 克碳-12 恰好包含一摩尔 (6.02×1023) 个分子。这是一个被称为阿伏伽德罗常数的测量值。使用阿伏伽德罗常数可以轻松地在原子质量、克和粒子之间转换。
在化学中,乘以测量值不像在数学中那样乘以。在数学课上,5 * 92 等于 460,但在化学中等于 500。这是因为 5 只有一个有效数字,所以答案必须四舍五入到一个有效数字。另一方面,如果乘以 5.0 和 92,则答案在两个学科中都是 460。
- 首先,将所有数字垂直对齐,就像你要加它们一样。不要写任何额外的零作为占位符。
- 添加
- 四舍五入到每个数字中包含数字的最小的位数。
例如:210 + 370. + 539
210 370. 539 +---- 1119 ≈ 1120
- 固体 (s) - 具有确定的形状和体积。在原地振动,但不会流动。
- 流体 - 呈现容器的形状。
- 液体 (l) - 具有确定的体积
- 气体 (g) - 可变体积(可压缩)
- 德谟克利特 - 提出原子概念的哲学家。
- 安托万·拉瓦锡 - 发现了质量守恒定律,该定律指出质量在化学反应中不会出现或消失,只会重新排列。
- 约翰·道尔顿 - 第一位用科学方法描述原子理论的科学家。
- 物质是由称为原子的不可破坏的粒子构成的。
- 相同元素的原子是相同的。
- 化合物是由两个或多个原子结合在一起形成的。
- 化学反应是原子的重新排列。
- J.J. 汤姆逊 - 发现了电子。
- 罗伯特·密立根 - 发现了电子的质量和电荷。
- "葡萄干布丁模型" - 原子就像布丁一样,电子像葡萄干一样。
- 欧内斯特·卢瑟福 - 通过他的金箔实验,发现了原子核。由于他射入金箔的大多数α粒子没有发生偏转,他得出结论,原子的大部分是空旷的空间。
原子由质子、中子和电子组成。质子和中子的质量约为 1 AMU,而电子的质量可以忽略不计。元素由原子中的质子数决定,称为原子序数。中子的数量会有所不同,从而产生不同质量的不同同位素。原子的原子质量是其质子和中子的总和,质子和中子都位于原子核中。
电子被排列成围绕原子核的电子层。每个电子层有 1-4 个亚层,亚层本身有 1-7 个轨道,每个轨道可以容纳两个电子。
| 电子层 | 亚层 | 轨道 |
|---|---|---|
| 1 | s | 1 |
| 2 | s, p | 1 + 3 = 4 |
| 3 | s, p, d | 1 + 3 + 5 = 9 |
| 4 | s, p, d, f | 1 + 3 + 5 + 7 = 16 |
- 泡利不相容原理 - 按照以下图像,首先填充最低能量亚层。
- 例外:镧系元素和锕系元素中的元素包含细微差别,并不严格遵循 gif 模式。这些系列两侧的元素确实遵循 gif。
- 洪特规则 - 在将第二个电子放入这些轨道中的任何一个之前,先在亚层中的每个轨道上填充一个电子。
例如,钠 = 1s22s22p63s1
价层电子对互斥理论 (VESPR)。化合物中的电子会尽可能地远离彼此。成键电子对比非成键电子对的排斥力更强。
电子对分离需要轨道杂化。这些杂化轨道从sp到sp3d2,包含2到6对电子。这导致了分子中每个中心原子的多种形状。
| ↓有效电子对和杂化 孤对电子→ | 0 | 1 | 2 | 3 |
|---|---|---|---|---|
| 2 sp | 线性 180° | 不适用 | 不适用 | 不适用 |
| 3 sp2 | 平面三角形 120° | 弯曲形 | 不适用 | 不适用 |
| 4 sp3 | 四面体 109.5° | 三角锥形 | 弯曲形 | 不适用 |
| 5 sp3d | 三角双锥 120° 90° 180° | 跷跷板形 | T形 | 线性 |
| 6 sp3d2 | 八面体 90° 180° | 四方锥形 | 平面正方形 | 不适用 |
- σ键 - 在所有化合物中形成
- π键 - 每个在两个原子之间共享的额外的电子对形成一个或多个π键。这些键比σ键更弱。

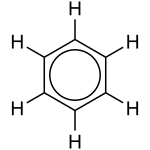
有时,有不止一种“正确”的方法来绘制物质。实际上,物质的结构是绘制变化的平均值。
你应该已经熟悉这个。每一行被称为周期,每一列被称为族或族。非金属和金属由右侧的锯齿形线隔开。(氢也是非金属)。位于该线附近的元素被称为类金属,它们兼具金属和非金属的特性。
氧化数是追踪电子的一种方法,确保化合物的各个部分以正确的比例匹配。
- 纯元素的氧化数为零。
- 单原子或多原子离子,氧化数等于它们的电荷。
- 共价化合物和离子化合物的氧化数之和必须等于零。
- 与其他元素键合的1族金属的氧化数为+1,2族金属的氧化数为+2,卤素的氧化数为-1,除非与氧键合。
- 与其他元素键合的氧的氧化数为-2,除非它在氢氧根(OH)中,此时为-1,或与氟键合,此时为正数。
- 与其他元素键合的氢的氧化数在与金属键合时为-1,在与非金属键合时为+1。
(第一个元素的名称) (第二个元素的名称 + 化物) 例如氯化钠。
氢(非金属+酸) 例如氢溴酸 (HBr)
(第一个元素的名称) (多原子离子的名称) 例如氢氧化钠 (NaOH)。请注意,有一个例外 - 铵离子 (NH4+) 可以代替第一个元素。
按以下顺序:(氢)(非金属)(氧)
如果离子以-ate结尾,则酸将命名为(非金属)酸。例如,H2SO4 包含硫酸根离子。它被称为硫酸。
如果离子以-ite结尾,则酸将命名为(非金属)亚酸。
一些元素,特别是过渡金属,可以有多个氧化数。因此,必须用罗马数字写出正氧化数。例如,CuO 是氧化铜 (II),Cu2O 是氧化铜 (I)。

