感觉系统/节肢动物
蚂蚁是一个非常成功的物种,这在很大程度上归功于它们错综复杂的社会组织和简单的感官处理能力。由于蚂蚁生活在数百万成员的群体中,因此强大的沟通能力,如向其他个体发出关于食物来源或外来群体位置和丰富程度的信号,至关重要。跟踪它们的环境可以让蚂蚁调节它们的觅食活动。蚂蚁还利用它们的嗅觉返回巢穴,并利用信息素沉积来调节群体规模的涌现行为,找到通往食物来源的最短路径。
蚂蚁的嗅觉由信息素完成,信息素是由不同的腺体产生的有机小分子,如杜氏腺、毒腺、肛腺以及脚、腹部和胸部的腺体。这些信息素用于交换有关交配、捕食者、路径标记或食物来源的信息。一些蚂蚁物种,如法老蚁,具有不同的效价和挥发性的信息素。信息素可以是高挥发性或低挥发性,并且可以是引诱剂或驱避剂。这使得觅食的蚂蚁能够强化通往丰富食物来源的路线,以放大有益路径并减少通往稀缺食物来源的引诱。这样就创建了一个信息素网络,它很容易适应不断变化的环境条件。在某种程度上,蚂蚁群体就像一个单一的超级生物,可以通过短期和长期记忆化学地保留记忆。

一项关于沙漠蚂蚁的实验揭示了嗅觉与寻路之间有趣的联系:研究人员用四种先前被证实不具有吸引或排斥性质的香味物质标记了蚂蚁巢穴入口(地面上的一个小洞),该入口在视觉上并不显眼。这四种有机分子被放置在围绕巢穴入口的假想正方形的四个角上。蚂蚁随后学会将气味与巢穴入口联系起来,因此在测试条件下(没有巢穴存在),它们会主动寻找气味方格的中心。然而,当气味的空间排列发生改变时,蚂蚁不再识别它,这表明它们用于导航的嗅觉记忆具有重要的空间维度。最后,当切除一只触角(蚂蚁拥有两只带有嗅觉受体的触角)时,蚂蚁也无法识别气味方格。这使研究人员得出结论:蚂蚁“以立体声的方式闻到周围环境”。 [1]
快速找到通往短暂食物来源的最短路径对于蚂蚁的生存至关重要。当蚂蚁被放置在一个巢穴和食物来源通过两条不同长度的路径连接的环境中时,它们会越来越倾向于选择更短的路径。最初,蚂蚁会在两条路径之间随机选择,但选择更短路径的蚂蚁能够多次往返,从而在其路径上留下更多的化学引诱剂。更高的信息素浓度会诱使更多蚂蚁选择短路径,从而在每次旅程中强化这种偏好。这表明一个复杂的导航问题可以通过一个具有单一正向信息素的系统中出现的群体行为来解决。 [2]
触角的作用和形态
[edit | edit source]
蚂蚁的主要感觉输入通道是触角。通过移动触角,它们可以触摸、品尝和闻到触手可及的一切。然而,这些触角的功能远不止味觉和嗅觉:通过它们感知的化学信号对于它们生存所需的多种行为功能至关重要。这些功能包括配偶识别和选择、区分巢穴同伴和外来者、运动和探索新的食物来源、交流和防御行为。也有一些蚂蚁亚科(行军蚁亚科、Leptanilinae 亚科、Cerapachyinae 亚科)是完全失明的,它们完全依靠化学感觉信号。因此,蚂蚁主要是通过化学感应形成它们所闻名的高效的有序群体。蚂蚁的触角独特之处在于它是弯曲的,或者说是“肘状的”。它由一个被称为柄节的长而细长的基部组成,以及三个到十一个远端节段,统称为鞭节或末节。柄节和末节以一个角度相连,因此赋予了蚂蚁触角其特有的弯曲形状。每个节段称为触角节,所以蚂蚁的总触角节数量在四到十二之间。
触角包含三种类型的感官受体:嗅觉受体(ORs)、味觉受体(GRs)和离子型谷氨酸受体(IRs)。GRs 促成蚂蚁的味觉,并感知有限数量的信息素,而 IRs 是经过严格调整的受体,其主要用途是检测有毒和有毒化合物。蚂蚁的 IR 和 GR 水平与其他昆虫的 IR 和 GR 水平相当;然而,ORs 水平(负责对气味物质和更广泛的信息素做出反应)在蚂蚁中不成比例地高,使它们能够检测到比其他昆虫更低的浓度的化学物质。
触角的神经元形态
[edit | edit source]感觉神经元位于触角上的纤毛,即毛发状结构。这些结构内部是感觉器滤器(也称为感觉器),一种角质层装置,包含一组感觉神经元及其辅助细胞。每个触角节包含几种不同类型的感觉器和分泌腺细胞,可以用扫描电子显微镜观察。感觉器的类型不仅在蚂蚁物种之间有所不同,而且对于所讨论的蚂蚁的性别和品级也是特异性的。感觉器的不同类型和功能根据感觉器的形态特征(例如,孔的存在或不存在),人们可以推测它们的功能以及它们如何服务于特定的感觉方式。有七种不同的感觉器类型,每种类型都有其自己的输入类型: [3]
- 1. 刚毛状感觉器:主要与机械感觉输入有关
- 2. 毛状感觉器:嗅觉
- 3. 弯曲毛状感觉器:嗅觉,包括信息素
- 4. 基底锥状感觉器:嗅觉
- 5. 凹锥状感觉器:嗅觉
- 6. 壶状感觉器:没有孔,包含对湿度做出反应的湿度感受器、对温度做出反应的热感受器以及对 CO 2 信号做出反应的专门感受器
- 7. 钟状感觉器:嗅觉
这些感觉神经元在蚂蚁中的生理功能主要通过生物测定技术和电生理记录来研究,使用了各种不同的蚂蚁物种。同样,并不是所有的感觉器都总是在一只蚂蚁身上存在,但通常存在五种主要的类型:基底锥状感觉器、刚毛状感觉器、弯曲毛状感觉器、凹锥状感觉器和壶状感觉器。它们也都有一个特征性的突出的孔板(弯曲毛状感觉器)结构,与平板相比,这提供了更高的气味分子吸收概率。在基底锥状感觉器(长钉)、弯曲毛状感觉器(长毛发)和凹锥状感觉器(大开口)中发现的较大的表面积也有利于收集更多分子。 [4]。雄性和雌性主要的感官器类型是弯曲毛状感觉器,它们起到嗅觉的作用。
嗅觉受体神经元
[edit | edit source]OR 神经元位于专门的嗅觉感觉器上。每个 OR 神经元通常表达一个受体,以及一个称为 Orco(嗅觉受体共受体)的受体,共同形成一个功能性受体单元。OR 神经元将化学活性转化为传递到触角叶中嗅球的神经信号。特定蚂蚁身上存在的感觉器取决于蚂蚁的物种、品级和性别。一些 OR 基因家族成员也特别富含工蚁触角。OR 神经元也被认为是蚂蚁检测蚁后表皮碳氢化合物的主要机制,这反过来调节工蚁特异性行为。
感觉器的性别和品级二态性与功能相关
[edit | edit source]蚂蚁群体由非繁殖的雌性和繁殖的雄性和雌性组成。所有工蚁、兵蚁和蚁后都是雌性。为数不多的可育雄性蚂蚁不在群体中工作,它们只存活几个月,以便在婚飞期间为蚁后受精。感觉器是性别和品级二态性的:它们根据蚂蚁的性别和品级而有所不同。总的来说,雄性拥有的 ORs 数量约为雌性的三分之一。最近的研究表明,雄性也拥有专门针对蚁后产生的信息素进行调谐的 ORs。关于红火蚁的扫描电子显微镜研究为我们提供了一些其他有趣的例子,例如雄性触角在所有节段上都有多孔感觉器。感觉器形态的差异被认为不仅与蚂蚁的功能需求相关,而且还决定了这些需求。换句话说,对任务相关气味和信号敏感的感觉器的存在或不存在可能是群体中确定任务分配的可能机制。例如,在入侵红火蚁中,工蚁是多型的,感觉器的总数取决于触角末节的长度,这构成了对嗅觉信号敏感性的差异。
参考文献
[edit | edit source]- ↑ Kathrin Steck, Markus Knaden 和 Bill S. Hansson。沙漠蚂蚁以立体声的方式闻到周围环境吗?动物行为,79(4):939-945,2010。
- ↑ S Goss, J L Deneuborg 和 J M Pasteels。阿根廷蚁的自我组织捷径。自然科学,76(1959):579-581,1989。
- ↑ Klaus Dumpert。Lasuis fuliginosus (Latr.) (Hymenoptera, Formicidae) 触角节上的感觉器结构和分布。动物形态学,73(2):95-116,1972。
- ↑ Yoshiaki Hashimoto。蚁科 (Hymenoptera) 触角上感觉器的独特特征。应用昆虫学与动物学,25(4):491-501,1990。
螳螂虾的视觉系统
[edit | edit source]
螳螂虾或口足目动物,是一类甲壳类动物,通常长10至20厘米。它们颜色鲜艳,生活在热带或亚热带海洋的浅水区。口足目动物的胸部大部分被坚韧的甲壳覆盖,头部位于前方,两只眼球长在眼柄上。它们有多对肢体,其中第二对肢体特别大,以其强大的打击能力而闻名。然而,它们最出名的是其复杂的视觉系统。 [1]
螳螂虾拥有动物界中最复杂的视觉系统之一。与大多数其他物种使用2-4种光感受器类型来进行颜色视觉不同,它们使用12种!此外,它们有4-7种受体类型(取决于物种),对线性和圆偏振光敏感。 [2] 这让人们不禁思考螳螂虾如何看待世界,以及它们是否拥有与我们三维空间不同的12维颜色空间。
科学家们假设,拥有如此多的光感受器类型,如果螳螂虾对光谱敏感性进行模拟比较,它们将能够区分仅相差几纳米的颜色。相反,最近的一项研究表明,它们很难区分相差小于25纳米的颜色,这大约是不同光感受器敏感度峰值之间的距离。这表明这些动物不像人类那样通过比较来自不同光感受器的输入来处理视觉信息,而是检测哪个受体发出最强信号。 [2] 这意味着螳螂虾没有12维的连续颜色空间,而是一个由12个颜色“箱”组成的离散颜色空间。这种系统的优势在于,它允许动物快速可靠地确定颜色,而不会出现多维颜色空间中出现的延迟。然而,该系统的的神经处理机制还有待确定。 [2]
螳螂虾的眼睛是复眼,由称为小眼的光学单元组成。每个小眼都有一个被角膜覆盖的透镜,在透镜后面有一个称为视杆的光导体。围绕视杆的是光感受器,它们对紫外线或人类可见光范围内的光敏感。 [3] 眼睛通常呈椭圆形,被分为形态学上不同的区域。 [4] 每只眼睛在水平方向上被分为三个区域:背半球、中带和腹半球,它们都探索空间。 [2] [4] 人们认为,这两个半球使动物在每只眼睛上都能拥有立体视觉。小眼按行排列,每行都有相同的形态。 [4]

眼睛半球中的小眼类似于其他甲壳类动物中发现的小眼。 [5] 中带包含较大的、特化的,拥有负责大部分光谱多样性的光感受器的小眼。 [6] 中带水平地位于两个半球之间,使动物能够将地平线上的任何物体都保持在焦点区域内,而无需进行太多水平的扫视眼球运动。实际上,大多数扫视眼球运动都是垂直的。 [4] 中带的第1至第4行参与颜色视觉,而第5和第6行检测线性和圆偏振光。在第1至第4行中,有12种不同的细胞类型,每种细胞对不同波长的光敏感。此外,在最前面的四行中,有4种对紫外线敏感的细胞类型。 [2] [4]
每个视杆都有一个独立的光学系统,这导致了大量的光学单元。这样,一个小眼中的所有光感受器都可以观察到同一个视野,以便同时分析不同的特性。同一只眼睛中的两个不同区域甚至可以观察到同一个视野,这使得系统灵活,并增加了并行处理的可能性。缺点是与眼睛大小相比,空间分辨率较低。每个眼睛半球中的小眼能够看到同一个视野,使每只眼睛都具有立体视觉。 [5]
每只眼睛都长在眼柄上,并且可以借助六组肌肉在所有轴线上自由活动。此外,每只眼睛可以独立于另一只眼睛运动。每只眼睛的独立运动使得难以利用双眼立体视觉。相反,它们可能利用每只眼睛两个半球视野的重叠来估计距离。当眼柄运动时,远处的物体运动速度比近处的物体慢,这增强了它们的深度知觉。 [5] 半球中小眼的顶部由一个晶状体锥体上方的角膜组成。这部分专门用于光学,并将入射光聚焦到下面的光敏视杆上。视杆由八个受体细胞组成,顶部是R8细胞,下面是围绕视杆的R1-7细胞。这些细胞形成一个光导体。R8细胞只对紫外线敏感,而R1-7细胞对大约500纳米的波长敏感。R8细胞对偏振不敏感,而R1-7细胞有两种类型的受体,它们对彼此正交的偏振敏感。 [5]
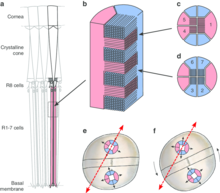
眼睛中带中的小眼与半球中的小眼不同,中带包含三种类型的小眼。第一种类型的小眼位于最腹面的两行,它们感知偏振光。这两行中的每个R8细胞都感知彼此正交的偏振面。R1-7细胞使用两种类型的受体来感知大约500纳米的正交波长。R8受体还会将圆偏振光转换为线性偏振光,然后由R1-7受体感知。
第二种类型的小眼位于最背面的四行中的两行。R1-7细胞被分成两层,因此入射光首先穿过对紫外线敏感的R8部分,然后穿过R1-7的远端部分,最后穿过近端部分。每层在光到达下面的层之前吸收某些波长,共同创造了窄带光感受器。
第三种类型的小眼位于剩余的两行。它们包含受体层之间的彩色光稳定滤光片,因此入射光被这些滤光片以及受体的吸收所过滤。
第二和第三种类型的小眼对偏振不敏感。第二和第三种类型的小眼的四行,每行都包含两种类型的受体层。这八种受体类型总共有不同的视觉色素,因此它们共同覆盖了大约400-700纳米的光谱范围。再加上紫外线受体和偏振敏感度,总共约有16-21种受体类别,具体取决于物种。 [5] [2]
与人类不同,螳螂虾能够探测到紫外线。紫外线光感受器在眼睛中均匀分布,这表明螳螂虾的紫外线视觉是其颜色视觉系统的一部分,其敏感度范围在300-700纳米波长之间,而人类的敏感度范围在400-700纳米之间。紫外线敏感度太窄,不可能仅仅来自视觉色素的吸收,这使科学家们认为它们是在光感受器中用紫外线滤光片调节的。 [7]
最近的一项实验发现,在中带中有四种对紫外线敏感的紫外线吸收MAA(类菌孢素氨基酸)。这些色素充当短通或长通紫外线滤光片,作用于视网膜中的同一视觉色素,从而将紫外线光谱的灵敏度提高数倍。这样,它们可以产生六种类型的紫外线受体。 [6] [8]
在深水中,由于其与周围蓝色形成对比,荧光对颜色的贡献比陆地更大。许多海洋生物具有荧光色彩,其中之一就是螳螂虾。螳螂虾物种Lysiosquillina glabriuscula的触角鳞片和甲壳上具有荧光标记。据估计,荧光在该动物栖息的深度范围内,约占标记物总光子的7-10%。从L. glabriuscula的角度来看,荧光更为重要,因为它们具有特殊的视觉系统,并占总光子数的30%。荧光使动物能够在短波长无法到达的水下增强其颜色信号。 [9]
偏振视觉
[edit | edit source]偏振可以用斯托克斯参数描述,
其中 表示强度,而 分别代表水平、垂直、对角线、反对角线、右手圆偏振和左手圆偏振。S0是总强度,它不会影响偏振。偏振光在自然界中很常见,尤其是反射光,节肢动物和甲壳类动物对线性偏振光很敏感。例如,它可以提供有关物体纹理和方向的信息。单个线性偏振分量提供了更大的对比度,尤其是在湍流水中,而更多线性分量可能会影响方向、导航、猎物检测、捕食者躲避和种内信号。
最佳偏振视觉是对所有六种线性偏振和圆偏振分量同时敏感,而螳螂虾的Gonodactylidae科是第一个被发现具有这种能力的生物。它们眼睛的背侧和腹侧半球感测线性偏振,彼此旋转45度。使Gonodactylidae科特殊的是,它们对中带两排圆偏振的敏感性,使其能够测量所有六个斯托克斯参数。除了这些解剖学特征外,它还具有测量斯托克斯参数的神经元特征。 [3] [10] [5]
滤光视觉
[edit | edit source]不同的螳螂虾物种生活在不同的深度。生活在浅水的动物比生活在深水的动物暴露在更广泛的光谱照明下。对螳螂虾物种Haptosquilla trispinosa的实验表明,它们在其感光器前使用彩色滤光片来调节光谱敏感性。在生活在浅水的动物中,滤光片被用于大多数可见光谱。同时,那些生活在深水的动物会改变它们的滤光片,以透射更短的波长(绿蓝光),因为更长的波长会被水衰减。这使它们能够区分海洋中短波长光线的细微差别。 [11]
视觉处理
[edit | edit source]螳螂虾的视觉处理与人类不同,可以与人工系统进行比较,因为它们使用串行和并行处理。与大多数其他动物不同,螳螂虾必须移动它们的双眼才能从环境中收集某些类型的视觉信息。这在于视觉分析最重要的区域位于狭窄的中带,它只能扫描视觉空间的一部分。螳螂虾通过缓慢地上下移动眼睛来解决这个问题,从而获得有关整个视野的颜色、偏振和紫外线强度的信息。
螳螂虾的视觉处理大部分发生在眼睛内部,甚至发生在单个感光器中。这减少了将信息传递到更高区域所需的数据量。从视网膜来看,信息似乎通过多个并行通路传送到中枢神经系统,使其能够最大限度地减少更高水平的处理。螳螂虾将视觉光谱分成离散通道的另一个优点是其颜色恒常性。具有少量具有宽波长光谱的受体的视觉系统可以强烈地适应远离其峰值敏感波长的波长,这使得难以识别不同环境中的颜色,例如水下。 [5]
发达的视觉系统带来的益处
[edit | edit source]螳螂虾的生活方式涉及到捕食猎物时极快的运动,这使得快速处理视觉信息变得至关重要。 [2] 螳螂虾不仅为了捕食猎物而攻击,还为了与同类争斗而攻击。 据信,这进化了它们的信号行为,其中涉及偏振光和颜色。 它们在信号传达中比其他甲壳类动物更广泛地使用颜色,据信它们具有高色恒定性的特殊视觉系统使这成为可能。 [5]
启发科技
[edit | edit source]螳螂虾视觉系统的许多特征都可能影响人工光学系统的发展。 在设计需要色恒定性的光学系统时,螳螂虾的视觉系统可以作为模型,其中窄光谱通道提高了精度。 与目前的光学传感器特性相反,运动对于螳螂虾的视觉至关重要。 这打开了将运动可能性集成到光学传感器中的想法。 [5] 螳螂虾的眼睛设计是视觉电子设备的良好模型,因为它能够在各个单元内进行分析。 它在信息传递到更高中心之前在眼睛中的视觉处理也是高效、低功耗人工光学系统的灵感来源。 在传感器级别处理数据可以减少带宽和所需的功率。 它们的偏振敏感性也启发了科学家开发偏振传感器。 事实上,螳螂虾的偏振敏感小眼排列已被复制,铝纳米线作为线性偏振滤光片位于光电二极管顶部,以创建 CMOS 成像器。 这种实时偏振成像使以前无法实现的癌组织早期诊断成为可能,并且具有许多潜在的未来应用。 [12]
参考文献
[edit | edit source]- ↑ Ross Piper,非凡的动物:奇特和不寻常动物百科全书,Green-wood Press,2007。
- ↑ a b c d e f g Hanne H. Thoen 等,螳螂虾的另一种颜色视觉形式,科学 343:411- 413,2014。
- ↑ a b Kleinlogel S, White AG,虾的秘密世界:偏振视觉的最佳体现,PLoS ONE 3(5):e2190,2008。
- ↑ a b c d e David Cowles,Jaclyn R. Van Dolson,Lisa R. Hainey,Dallas M. Dick,螳螂虾 Hemisquilla californiensis Stephenson, 1967(甲壳纲:口足目)的不同眼区用于检测物体,实验海洋生物学与生态学杂志 330 (2): 528534, 2006。
- ↑ a b c d e f g h i Thomas W. Cronin, Justin Marshall, 螳螂虾眼睛中的并行处理和图像分析,生物学通报 200 (2): 177183, 2001。
- ↑ a b Michael Bok,Megan Porter,Allen Place,Thomas Cronin,生物防晒霜调节螳螂虾的多色紫外线视觉,当代生物学 24 (14): 163642, 2014。
- ↑ Justin Marshall,Johannes Oberwinkler,紫外线视觉:螳螂虾多彩的世界,自然 401 (6756): 873874, 1999。
- ↑ Ellis R. Loew,视觉:二加四等于六,当代生物学 24 (16): 753-755, 2014。
- ↑ C. H. Mazel,T. W. Cronin,R. L. Caldwell,N. J. Marshall,螳螂虾信号传达的荧光增强,科学 303 (5654): 51, 2004。
- ↑ Tsyr-Huei Chiou 等,口足目甲壳动物的圆偏振视觉,当代生物学 18 (6): 42934, 2008。
- ↑ Thomas W. Cronin,Roy L. Caldwell,Justin Marshall,螳螂虾的可调色视觉,自然 411, 547, 2001。
- ↑ T. York 等,生物启发的偏振成像传感器:从电路和光学到信号处理算法和生物医学应用,IEEE 会刊 102 (10): 14501469, 2014。
蜘蛛的视觉系统
[edit | edit source]介绍
[edit | edit source]虽然一些蜘蛛物种高度发达的视觉系统已经成为几十年来广泛研究的主题,但诸如动物智力或认知之类的术语通常不用于蜘蛛研究的背景中。 相反,蜘蛛传统上被描绘成相当简单的、受本能驱使的动物(Bristowe 1958,Savory 1928),以预编程的模式处理视觉输入,而不是主动解释从它们的视觉器官接收到的信息,以做出适当的反应。 虽然这似乎仍然是大多数蜘蛛的情况,它们主要通过触觉而不是视觉线索与世界互动,但一些蜘蛛物种已经显示出对其眼睛的惊人智能使用。 考虑到它在身体内的有限尺寸,蜘蛛的光学装置和视觉处理性能非常出色。 [1] 最近的研究表明,在研究诸如视觉引导的跳蛛(跳蛛科)的复杂狩猎方案(它们会跳跃高达自身身长的 30 倍去捕捉猎物)或狼蛛(狼蛛科)识别潜在配偶不对称的能力等主题时,蜘蛛世界中对视觉线索的非常复杂的使用。 即使是夜行性的杯状蜘蛛(栉足蛛科),主要依赖于其他感觉器官,或者在夜间捕猎的食人魔脸蜘蛛,它们会编织小网并将其扔向靠近的猎物,视觉系统仍然高度发达。 这些发现不仅令人着迷,而且还激励了其他科学和工程领域,例如机器人技术和计算机引导的图像分析。
蜘蛛解剖结构的一般结构
[edit | edit source]
蜘蛛的解剖结构主要由两个主要的身体部分组成,即前体和后体,它们也分别被称为头胸部和腹部。 所有肢体以及感官器官,包括眼睛,都位于前体中。 除了节肢动物的视觉系统具有复眼外,现代蛛形纲动物的眼睛是单眼(简单的眼睛,由覆盖着充满玻璃状液体的凹坑的透镜组成,底部有一个视网膜),蜘蛛有六或八个,通常排列在三个或四个横跨前体背甲的排成。 总的来说,99% 的所有蜘蛛都有八只眼睛,其余 1% 中几乎所有都有六只眼睛。 只有六只眼睛的蜘蛛缺少“主要眼睛”,这些眼睛将在下面详细介绍。
眼睛对被称为前正中眼 (AME)、前侧眼 (ALE)、后正中眼 (PME) 和后侧眼 (PLE)。 面向前方的较大主要眼睛是前正中眼,它们为蜘蛛提供了最高的空间分辨率,但代价是视野非常窄。 较小的朝前的眼睛是前侧眼,具有中等视野和中等空间分辨率。 两个后眼对是相当外围的,次要眼睛,具有宽视野。 它们对弱光条件极其敏感。 蜘蛛利用它们的次要眼睛来感知运动,而它们的主要眼睛则允许形状和物体识别。 与昆虫视觉相反,基于视觉的蜘蛛大脑几乎完全致力于视觉,因为它只接收视神经,并且只包含视神经节和一些联想中心。 大脑显然能够识别物体运动,但更重要的是还能通过看到以特定角度相对于身体的腿(线)来将对应物分类为潜在配偶、对手或猎物。 这种刺激将导致蜘蛛分别表现出求爱或威胁的迹象。
蜘蛛的眼睛
[edit | edit source]虽然蜘蛛的眼睛可能被称为“相机眼”,但它们在细节上与哺乳动物或其他动物的“相机眼”大不相同。为了将高分辨率的眼睛放入如此小的身体,无论是昆虫的复眼还是人类所拥有的球形眼睛,都无法解决这个问题。蜘蛛身上的单眼是光学上更好的解决方案,因为它们的分辨率不受透镜折射的影响,而复眼则会受到这种影响。如果用具有相同分辨率的复眼替换蜘蛛的眼睛,它根本无法塞进蜘蛛的头胸部。通过使用单眼,一些蜘蛛的空间分辨率更接近哺乳动物,而不是昆虫,尽管它们的大小相差悬殊,且只有几千个感光细胞,例如跳蛛的眼睛,而人类视网膜则有超过 1.5 亿个感光细胞。

大多数蜘蛛物种中存在的正中前眼 (AME) 也称为主眼。下图说明了主眼结构及其组成部分的细节,并通过跳蛛 Portia (跳蛛科) 的 AME 进行了解释,该物种以其高空间分辨率的眼睛和视觉引导行为而闻名,尽管其体型非常小,仅为 4.5-9.5 毫米。
当光束进入主眼时,它首先会穿过一个大型角膜透镜。这个透镜具有较长的焦距,能够放大远处的物体。两只主眼的角膜透镜的组合视野大约覆盖了跳蛛前方 90° 的范围,但具有所需清晰度的视网膜太大,无法塞进蜘蛛的眼睛。令人惊讶的是,解决方案是一个小的、细长的视网膜,它位于一个长而窄的管子和管子末端的一个第二透镜(一个凹坑)后面。角膜透镜(具有长焦距)和长眼管(放大角膜透镜的图像)的这种组合类似于望远镜系统,使一对主眼类似于一对双筒望远镜。
跳蛛在四个感光层上依次捕获光束,这些感光层彼此相邻(相比之下,人类视网膜仅在一个平面上排列)。这种结构不仅允许在有限区域内拥有更多感光器,而且还能实现彩色视觉,因为光束会被透镜系统分成不同的颜色(色差)。因此,不同波长的光会在不同的距离处聚焦,这些距离对应于视网膜层的位置。虽然跳蛛使用它们的主眼可以分辨绿色(第 1 层 - 约 580 纳米,第 2 层 - 约 520-540 纳米)、蓝色(第 3 层 - 约 480-500 纳米)和紫外线(第 4 层 - 约 360 纳米),但只有最靠后的两层(第 1 层和第 2 层)由于其紧密的感觉器间距而允许形状和形式的检测。
与人类的眼睛一样,第 1 层中有一个中心区域称为“中央凹”,在那里,感觉器间距被测量为约 1 微米。这被发现是最佳的,因为望远镜光学系统提供了足够精确的图像,可以在此分辨率下进行采样,但是任何更近的间距都会由于相邻感光器之间的量子级干扰而降低视网膜的采样质量。配备这种眼睛的 Portia 在视觉敏锐度方面远远超过任何昆虫:虽然蜻蜓 Sympetrum striolatus 拥有昆虫中已知的最高敏锐度 (0.4°),但 Portia 的敏锐度是其十倍 (0.04°),但眼睛却小得多。人类的眼睛具有 0.007° 的敏锐度,仅比 Portia 好五倍。凭借这种视觉精度,Portia 在技术上能够从 200 毫米的距离分辨出两个相距 0.12 毫米的物体。其他跳蛛眼睛的空间分辨率通常不会远低于 Portia。[2][3][4]
这种非凡的视觉能力在像跳蛛这样的小型动物身上是有代价的:Portia 每只主眼中的视网膜只有 2-5° 的视野,而它的中央凹甚至只有 0.6° 的视野。这是因为主视网膜具有细长的回旋镖形状,垂直跨越约 20°,水平仅跨越 1°,对应于大约六行感光器。这种严重的限制通过使用跳蛛的六块眼肌将眼管扫过场景的整个图像来弥补,这些眼肌附着在主眼管的外部,并允许与人类眼睛相同的三个自由度——水平、垂直、旋转。主视网膜可以水平和垂直移动高达 50°,并在光轴(扭转)附近旋转类似的量。
利用视觉线索进行复杂操作的蜘蛛会自发地移动它们的主眼视网膜,以“扫视”将中央凹固定在移动的视觉目标上(“跟踪”),或者通过“扫描”来完成,这可能是为了模式识别。今天看来,蜘蛛似乎通过以复杂模式移动眼管来顺序地扫描场景,从而使其能够处理大量视觉信息,尽管它们的脑容量非常有限。
自发性视网膜运动,即所谓的“微扫视”,是一种机制,据认为可以防止正中前眼的光感受器细胞适应静止的视觉刺激。Cupiennius 蜘蛛具有 4 块眼肌 - 两块背侧和两块腹侧肌 - 持续执行这种 2° 到 4° 的背侧正中微扫视,持续时间约 80 毫秒(当固定在支架上时)。2-4° 的微扫视运动与 Cupiennius 感光细胞之间的约 3° 角非常吻合,支持了其防止适应的功能的想法。相反,由机械刺激引起的视网膜运动(将一股气流直接吹向第二条步行腿的跗节)可能比自发性视网膜运动大得多,偏转幅度高达 15°。这种刺激将眼肌活动从静息状态下的 12 ± 1 赫兹自发活动增加到施加气流刺激时的 80 赫兹。然而,在这些实验中,两只主眼的主动视网膜运动永远不会同时激活,并且它们的方向之间也不存在任何关联。这两种机制,自发性微扫视以及主动视网膜运动带来的主动“凝视”,似乎允许蜘蛛仅使用它们的主眼有效地跟踪和分析静止的视觉目标,而无需通过身体运动来加强扫视运动。
然而,影响蜘蛛眼睛视觉能力的另一个因素是将不同距离的物体保持在焦点的难题。在人类的眼睛中,这是通过调节来解决的,即改变透镜的形状,但跳蛛采取了不同的方法:它们视网膜第 1 层中的感光器排列在一个“阶梯”上,距离透镜不同。因此,任何物体的图像,无论是距离眼睛几厘米还是几米,都会在第 1 层阶梯的某个部分聚焦。此外,跳蛛可以左右摆动眼管,而不会移动角膜透镜,因此会将每个视网膜的阶梯扫过角膜透镜的图像,从而依次获得物体的清晰图像。
由此产生的视觉性能令人印象深刻:像 Portia 这样的跳蛛可以准确地将物体聚焦在 2 厘米到无限远的距离上,实际上可以看清大约 75 厘米的物体。然而,识别物体所需的时间相对较长(似乎在 10-20 秒的范围内),因为从如此小的眼睛捕获高质量图像需要复杂的扫描过程。由于这种限制,像 Portia 这样的蜘蛛很难快速识别更大的捕食者,因为捕食者的体型很大,这使得这种小蜘蛛很容易成为鸟类、青蛙和其他捕食者的猎物。[5][6]
一项意外发现最近让研究人员大吃一惊,研究表明跳蛛使用一种被称为模糊视觉的技术来估计它们在跳跃之前对先前识别的猎物的距离。人类通过双眼视觉获得深度感知,而其他动物则通过转动头部或测量超声波响应来获得深度感知,而跳蛛则在其主要眼睛内执行此任务。与其他跳蛛物种一样,阿丹斯跳蛛的主要眼睛具有四个视网膜层,其中最下面两层具有对绿色脉冲做出反应的光感受器。然而,由于它距离内部透镜较远,绿光只能在最下面的第 1 层上聚焦清晰。第 2 层将接收聚焦的蓝光,但是这些光感受器细胞对蓝色不敏感,而是接收模糊的绿色图像。有趣的是,模糊程度取决于物体离蜘蛛眼睛的距离——物体越近,它在第二个视网膜层上的模糊程度就越大。同时,第一个视网膜层 1 由于其阶梯结构始终接收清晰的图像。因此,跳蛛能够通过比较最下面两个视网膜层的图像来使用一只静止的眼睛来估计深度。这通过让蜘蛛在充满绿光和相同亮度的红光竞技场中跳跃猎物来证实。如果没有使用绿色视网膜层的能力,跳蛛将反复无法准确判断距离并错过跳跃。

与负责物体分析和辨别的主要眼睛形成对比的是,蜘蛛的次要眼睛充当运动探测器,因此没有眼睛肌肉可以更广泛地分析场景。根据它们在蜘蛛甲壳上的排列方式,次要眼睛使动物能够拥有全景视觉,检测其身体周围几乎 360° 的移动物体。前侧和后侧眼(即次要眼睛)只有一种类型的视觉细胞,其最大光谱敏感度约为 535-540 纳米波长的绿光。不同蜘蛛科甚至同一蜘蛛科之间的次要眼睛的数量和排列方式差异很大,其结构也是如此:大型次要眼睛可能包含数千个感光体(视网膜的光敏感部分),并通过其对光的敏感性来支持猎人和夜行动物,而小型次要眼睛最多包含几百个感光体,并且只能提供基本的运动检测。与主要眼睛始终外翻(感光体朝向光线)不同,蜘蛛的次要眼睛是内翻的,即它们的感光体背离光线,就像脊椎动物(如人眼)一样。例如,在经过广泛研究的巨蟹蛛(Cupiennius salei)中,次要眼睛的空间分辨率在水平方向上最大,使蜘蛛能够即使用次要眼睛也能够很好地分析水平运动,而垂直运动在“平面世界”中生活时可能并不特别重要。
跳蛛的侧眼反应时间相对较慢,约为 80-120 毫秒,用一个 3° 大小(接收器间角)的方形刺激物穿过动物的眼睛来测量。蜘蛛做出反应的最小刺激运动距离为:当刺激物速度为 1°/s 时为 0.1°,当刺激物速度为 9°/s 时为 1°,当刺激物速度为 27°/s 时为 2.5°。这意味着,即使物体以较慢的速度仅移动侧眼接收器间角的十分之一,跳蛛的视觉系统也能探测到运动。如果刺激物变得更小,仅为 0.5°,则只有在很长时间延迟后才会出现反应,表明它们处于蜘蛛可感知运动的极限。
(夜间活动)蜘蛛的次要眼睛通常在感光体后面有一个反光层,这是一种反射光回到感受器以提高视觉灵敏度的晶体层。这使得夜间捕猎的蜘蛛能够拥有孔径高达 f/0.58 的眼睛,使它们即使在超低光照条件下也能捕获视觉信息。因此,包含反光层的次要眼睛在夜间被照明(例如手电筒)时很容易暴露蜘蛛的位置。 [7][8]
与神经科学的任何领域一样,我们对蜘蛛的中枢神经系统 (CNS) 了解甚少,特别是关于其在视觉控制行为中的作用。在所有蜘蛛中,巨蟹蛛的中枢神经系统研究最广泛,主要集中在中枢神经系统结构方面。截至目前,关于巨蟹蛛中枢神经元电生理特性的了解很少,其他蜘蛛在这方面的了解更少。
蜘蛛神经系统的结构与其身体的细分密切相关,但神经组织并非遍布全身,而是高度集中和集中。中枢神经系统由两个成对的、相当简单的神经细胞群(神经节)组成,它们通过神经与蜘蛛的肌肉和感觉系统相连。大脑是由这些神经节融合在头部嘴巴前后的部分形成的,并且大部分神经组织都填充在头胸部,而腹部不存在神经节。观察蜘蛛的大脑,它只从一个感觉系统(眼睛)接收直接输入——与任何昆虫和甲壳类动物不同。八条视神经从前面进入大脑,它们的信号在脑前部的两个视叶中处理。当蜘蛛的行为特别依赖于视觉时,例如跳蛛,视神经节占大脑体积的 31%,表明大脑几乎完全致力于视觉。对于巨蟹蛛,这一比例仍然高达 20%,而其他蜘蛛,如金丝蛛和巨蟹蛛仅为 2%。
主要眼睛和次要眼睛之间的区别在大脑中依然存在。两种类型的眼睛都有自己的视觉通路,有两个独立的神经节区域执行不同的任务。因此,蜘蛛显然并行处理其两种眼睛类型提供的视觉信息,次要眼睛专门用于检测物体的水平运动,而主要眼睛则用于检测形状和纹理。
虽然主要和次要视力似乎在蜘蛛的大脑中是不同的,但众所周知,大脑中这两个视觉系统之间存在令人惊讶的相互关系。在视觉实验中,在遮盖巨蟹蛛的主要或次要眼睛时,测量了其主要眼睛肌肉的活动。当在白色竞技场中用短序列的移动黑色条纹刺激动物时,只要次要眼睛检测到其视野中的运动,主要眼睛就会不由自主地移动。与没有呈现刺激相比,主要眼睛肌肉的这种活动增加,在用黑色油漆遮盖主要眼睛时不会改变,但在遮盖次要眼睛时会停止。因此,现在很清楚,只有从次要眼睛接收到的输入控制主要眼睛肌肉的活动。此外,蜘蛛的主要眼睛似乎没有参与运动检测,而这仅仅是次要眼睛的责任。
其他使用巨蟹蛛眼睛肌肉活动双通道遥测记录的实验表明,蜘蛛主动地注视着行走方向:在转弯之前、期间和之后,主要眼睛的同侧视网膜相对于行走方向发生偏移,而对侧视网膜保持其静止位置。这种情况与实际的光照条件无关,表明这是蜘蛛大脑发起的“自愿”注视。

跳蛛被认为是通过对视野进行扫描过程来识别形状和形式的,该过程包括对前正中眼睛的视网膜进行一系列复杂的旋转(扭转运动)和平移。正如“主要眼睛视网膜运动”部分所述,蜘蛛的视网膜很窄,形状像回旋镖,可以通过扫描视觉场景来与直线特征匹配。当调查一个新的目标时,眼睛以一种刻板的方式扫描它:以每秒 3-10° 的速度缓慢地左右移动并旋转 ± 25°,水平和扭转视网膜运动可以检测到不同位置和旋转的线条。这种方法可以理解为模板匹配,其中模板具有细长形状,并且只要视网膜与场景中的直线特征匹配,就会产生强烈的神经响应。这识别了一条直线,几乎不需要进行进一步的处理。
受跳蛛的视觉系统的启发,一种用于直线检测的计算机视觉算法作为优化问题(达科斯塔、达·弗朗西斯科·科斯塔)使用了相同的方法,即使用模板匹配顺序扫描场景。虽然著名的霍夫变换允许在图像中鲁棒地检测直线视觉特征,但其效率有限,因为在搜索直线时需要计算大部分甚至整个参数空间。相比之下,跳蛛视觉系统中使用的替代方法建议使用线性窗口搜索视觉空间,这允许在直线搜索过程中使用自适应搜索方案,而无需系统地计算参数空间。此外,以这种方式解决直线检测问题使其可以理解为一个优化问题,这使得计算机能够进行有效处理。虽然有必要通过实验找到控制基于退火的扫描的适当参数,但采用跳蛛直线检测路径的方法已被证明非常有效,特别是在设置了适当参数的情况下。[9]

虽然 杯形圆蛛 (Cupiennius salei) 主要依赖于其机械感觉系统进行捕食或交配行为,但它们也能够识别略微不同的视觉目标。当在距离蜘蛛 2 米的地方展示两个目标时,蜘蛛的行走路径取决于它们的视觉外观:如果需要在两个相同的目标(如垂直条)之间做出选择,杯形圆蛛不会表现出任何偏好。但是,动物明显更喜欢垂直条而不是倾斜条或 V 形目标。
研究表明,只有当主眼暴露时,蜘蛛才能识别不同的目标,而蜘蛛可以使用任何一只眼睛来检测目标。这表明许多蜘蛛的前侧 (次级) 眼睛的功能不仅仅是物体运动检测。当所有眼睛都被遮盖时,蜘蛛会表现出完全无方向的行走路径。
然而,将杯形圆蛛置于完全黑暗的环境中不仅会导致无方向的行走,还会引起步态的变化:蜘蛛不再使用全部八条腿行走,而只会用六条腿行走,并将前肢用作触角,类似于盲人使用拐杖。为了感受周围环境,伸出的前肢会上下以及左右移动。这仅限于第一对腿,并且仅受视觉输入的影响,当正常的室内光线切换到不可见的红外光时,就会发生这种情况。
跳蛛在用眼睛检测到运动后的行为取决于三个因素:目标的大小、速度和距离。如果目标尺寸超过蜘蛛尺寸的两倍,则蜘蛛不会靠近目标,如果目标向它移动,蜘蛛会试图逃脱。如果目标尺寸合适,则使用次级眼视觉分析目标速度。跳蛛会追逐以超过 4°/s 的速度快速移动的目标,并由其前侧眼引导。跳蛛会谨慎地靠近移动缓慢的目标,并用前中 (即主) 眼分析目标,以确定目标是猎物还是同种蜘蛛。这似乎是通过应用上述直线检测来实现的,以确定视觉目标是否有腿。虽然跳蛛已显示出只要潜在猎物具有合适的特征,它们就会靠近,但雄性在决定当前的配偶是否可能是潜在配偶方面更加挑剔。
实验表明,中央有一个点,两侧有类似腿的附肢的图画会导致求偶展示,这表明跳蛛使用视觉特征提取来检测目标中线性结构的存在和方向。此外,蜘蛛对被认为是同种蜘蛛的行为取决于不同的因素,例如参与的蜘蛛的性别和成熟度以及是否为交配时间。雌性狼蛛 (Schizocosa ocreata) 甚至能够辨别雄性次级性特征的不对称性,以便选择伴侣,这可能是为了避免后代发育不稳定。雄性前肢上醒目的簇状刚毛 (用于视觉求偶信号) 似乎会影响雌性伴侣选择,而由于腿部丢失和再生而导致的这些身体部位的不对称性显然会降低雌性对这些雄性蜘蛛的接受度。[10]
跳蛛在猎捕昆虫猎物时的潜行行为类似于猫潜行猎捕鸟类。如果次级眼看到视觉范围内有物体移动,它们会启动转向动作,将较大的面向前方的一对主眼转到位置,以便将物体的形状分类为配偶、竞争对手或猎物。即使非常小的低对比度点刺激以慢速或快速移动,也会引起这种定向行为。与杯形圆蛛一样,跳蛛也能使用其次级眼执行比运动检测更复杂的任务:在跳蛛仅能获得次级眼视觉信息并且主眼都被遮盖的情况下,向其展示视觉猎物线索,会使动物表现出完整的狩猎序列。这表明跳蛛的前侧眼可能是其视觉系统中最通用的部分。除了检测运动之外,次级眼显然还具有足够好的空间敏锐度,可以指导完整的视觉引导狩猎序列。
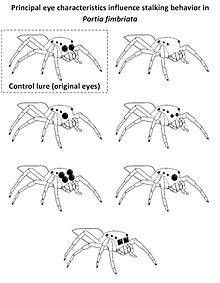
当使用主眼区分跳蛛猎物和非跳蛛猎物时,视觉线索也对跳蛛 (跳蛛) 非常重要。为此,跳蛛猎物的大主眼提供了重要的线索,跳蛛 (Portia fimbriata) 会对这些线索做出反应,在攻击前表现出隐蔽的潜行策略 (以非常缓慢的速度行走,触须缩回,在遇到目标时停止)。这种行为仅在识别猎物为跳蛛时使用。在实验中,人们利用计算机渲染的逼真的三维诱饵,对跳蛛 (Portia fimbriata) 进行实验,诱饵的主眼经过了修改。虽然完整的虚拟诱饵导致了隐蔽的潜行,但没有主眼或主眼比平时更小的诱饵 (如图中右侧所示) 引起了不同的行为。向跳蛛猎物展示仅有一个前中眼或一个带有两个放大次级眼的普通诱饵,会导致隐蔽的潜行行为,表明成功地识别出了跳蛛,而当跳蛛 (P. fimbriata) 面对独眼巨人式诱饵 (一个位于两个次级眼之间的中央主眼) 时,它们很少停止。带有方形边缘主眼的诱饵通常不会被归类为跳蛛,表明主眼边缘的形状是识别同类跳蛛的重要线索。[11]

一项研究对跳蛛属 (Phidippus) 中的蜘蛛进行了测试,以了解它们是否愿意穿越不利的开放空间,方法是在间隙的另一侧放置视觉目标。研究发现,蜘蛛是否冒着穿越开阔地面的风险,主要取决于距离目标的距离、目标相对于距离的相对大小以及目标的颜色和形状。在独立的测试运行中,蜘蛛向高远的目标移动的频率与向矮近的目标移动的频率相同,这两个物体在蜘蛛的视网膜上看起来大小相同。当选择移动到白色或绿色草状目标时,蜘蛛始终选择绿色目标,无论其与背景的对比度如何,这证明了它们能够在狩猎情况下使用颜色识别。[12]
当展示经过处理的真实植物和植物照片时,凤梨跳蛛 (Psecas chapoda) 能够通过视觉分析寄主植物叶片和莲座的结构特征来检测出有利的微生境。通过使用黑白照片,在研究期间可以排除其他线索 (如颜色和气味) 对蜘蛛寄主植物选择的影响,只留下形状和形式作为识别特征。即使只需要从照片中做出决定,凤梨跳蛛也始终偏爱莲座状植物 (龙舌兰科),它们的叶片又窄又长,而不是其他外观不同的植物,这证明某些蜘蛛能够仅根据视觉线索中植物特征的形状来评估和区分微生境的物理结构。[13]

蝴蝶和飞蛾通过约翰斯顿氏器保持平衡:这是一种位于蝴蝶触角基部的器官,负责维持蝴蝶的平衡感和方向感,尤其是在飞行过程中。
对于一些昆虫来说,对声音的感知对于交配行为很重要,例如果蝇 [14]。昆虫和甲壳类动物的听觉能力由弦音器官提供:机械感受器,对机械变形做出反应 [15]。这些弦音器官广泛分布在昆虫的整个身体中,功能各不相同:本体感受器对昆虫自身产生的力敏感,而外感受器对外部力敏感。这些感受器可以检测声音通过空气或水等介质传播时粒子振动产生的声音。远场声音是指空气粒子将振动以压力变化的形式从声源传播到很远距离的现象。近场声音是指靠近声源的声音,其中粒子的速度可以移动轻质结构。一些昆虫有可见的听觉器官,例如夜蛾的耳朵,而另一些昆虫则没有可见的听觉器官,但仍然能够感知声音。在这些昆虫中,“约翰斯顿氏器”在听觉中起着重要作用。
约翰斯顿氏器(JO)是大多数昆虫中存在的一种弦音器官。克里斯托弗·约翰斯顿是第一个在蚊子中描述这种器官的人,因此得名约翰斯顿氏器 [16]。显微镜科学季刊。1855 年,卷 s1-3, 10, pp. 97-102.. 该器官位于昆虫触角的柄部。它在双翅目(双翼)中发展了最高程度的复杂性,对于这些昆虫来说,听觉尤为重要 [15]。JO 由称为感觉单位的有序基础组成,称为感觉柱(SP)。感觉柱的数量在不同的动物中有所不同。JO 具有多种机械感觉功能,例如检测触觉、重力、风和声音,例如在蜜蜂中,JO(≈ 300 SPs)负责检测来自另一只“跳舞”蜜蜂的声音 [17]。在雄性蚊子(≈ 7000 SPs)中,JO 用于检测和定位雌性飞行声,以便交配 [18]。. 这些昆虫的触角专门用于捕捉近场声音。它充当物理机械传感器。
典型的昆虫触角有三个基本部分:柄节(基部)、梗节(柄部)和鞭节 [19]。一些昆虫的第三节有一个叫做刚毛的刚毛。图 1 显示了果蝇的触角。对于果蝇来说,触角部分 a3 松散地嵌入 a2 部分的插座中,并且在吸收声音能量时可以旋转 [20]。这会导致感觉柱的感觉神经元拉伸或压缩。在双翅目中,JO 感觉柱位于第二节触角部分 a2 梗节(Yack,2004)。JO 不仅与声音感知(外感受器)有关,它还可以充当本体感受器,提供有关鞭节相对于梗节的方向和位置的信息 [21]。

感觉柱是 JO 的基础感觉单位。一个感觉柱包含四种细胞类型 [15]:(1) 一个或多个双极性感觉细胞神经元,每个神经元都有一个远端树突;(2) 包裹树突的感觉柱细胞;(3) 一个或多个与感觉柱细胞远端区域相关的附着细胞;(4) 一个或多个包围感觉神经元细胞体近端区域的神经胶质细胞。感觉柱细胞包围感觉树突(纤毛)并与之形成感觉柱腔/感受淋巴腔。感觉柱腔是密封的。腔体充满淋巴液,据信淋巴液中钾含量高,钠含量低,因此与哺乳动物耳蜗中的内淋巴液非常相似。感觉柱根据不同的标准进行分类。帽细胞产生一个细胞外帽,它包裹纤毛尖端并将它们连接到第三节触角部分 a3 [22]。
第一型和第二型感觉柱在感觉细胞中纤毛节段的类型上有所不同。在第一型中,纤毛的直径是均匀的,除了在长度的 2/3 处有一个远端膨大。纤毛插入帽中而不是插入管中。在第二型中,纤毛节段的直径不断增大到一个远端膨大,其中可以密密麻麻地填充微管。远端部分以管的形式结束。单丝型和双丝型感觉柱在与感觉柱细胞和树突纤毛相关的细胞外结构上有所不同。单丝型感觉柱的树突尖端插入一个帽状结构中,该结构是一个电子致密的结构。在双丝型感觉柱中,尖端被一个电子致密的管子包围。单动型和异动型感觉柱根据感觉神经元数量来区分。单动型感觉柱有一个感觉细胞,而异动型感觉柱有多个。
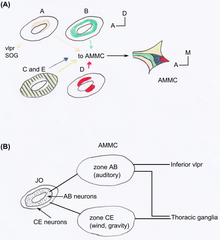
果蝇的 JO 由大约 277 个感觉柱组成,这些感觉柱位于 a2/a3 连接处和 a2 角质层(一种外部组织层)之间 [23]。果蝇的感觉柱是单丝型的 [20]。大多数是异动型,包含两个或三个神经元,因此 JO 包含大约 480 个神经元。它是果蝇最大的机械感觉器官 [14]。JO 对雄性果蝇求爱歌曲(由它们的翅膀产生)的感知使得雌性果蝇减少运动,而雄性果蝇则彼此追逐,形成求爱链 [24]。JO 不仅对感知声音很重要,而且对重力 [25]和风 [26] 感知也很重要。使用 JO 中的 GAL4 增强子陷阱系表明,果蝇的 JO 神经元可以在解剖学上分为五个亚群,A-E [23]。每个亚群在大脑中的触角机械感觉和运动中心 (AMMC) 都有不同的目标区域(见图 2)。Kamikouchi 等人表明,不同的亚群专门负责不同类型的触角运动 [14]。不同的亚群用于声音和重力响应。
为了研究JO神经元的活动,可以观察由触角运动引起的细胞内钙信号[14]。此外,果蝇应该被固定(例如,通过将它们安装在盖玻片上,并固定第二触角节以防止肌肉引起的运动)。触角可以使用静电力进行机械驱动。当声音能量被吸收时,触角接收器会振动,当果蝇行走时,触角会前后摆动。摆动和振动触角会在JO神经元中产生不同的活动模式:用恒力向后摆动接收器会导致JO前部产生负信号,后部产生正信号。向前摆动产生相反的行为。求偶歌(以约200Hz为主频率的脉冲歌)会引发广泛分布的信号。向前和向后摆动产生的相反模式反映了JO神经元相反的排列。它们的树突连接到触角柄解剖学上不同的两侧:接收器的前部和后部。向前摆动接收器会拉伸JO神经元前部,压缩后部神经元。由此可以得出结论,JO神经元被拉伸激活(即去极化),被压缩失活(即超极化)。
不同的JO神经元
[edit | edit source]JO神经元通常只靶向AMMC的一个区域,靶向相同区域的神经元位于JO内特征性的空间区域[23]。类似的投射神经元被组织成同心圆环或成对的簇(见图2A)。
用于声音感知的振动敏感神经元
[edit | edit source]A和B神经元(AB)在19 Hz到952 Hz之间被接收器振动最大程度地激活。这种反应是频率依赖的。B亚组对低频振动表现出更大的反应。因此A亚组负责高频反应。
用于重力和风感知的偏转敏感神经元
[edit | edit source]C和E对静态接收器偏转表现出最大活动。因此,这些神经元提供了关于力的方向的信息。与AB神经元相比,它们对触角的位移阈值更大[26]。然而,CE神经元可以对触角的微小位移做出反应(例如重力):重力会使触角尖端位移1 µm(见[14]的S1)。它们也对气流引起的较大位移做出反应(例如风)[26]。C区和E区神经元对气流方向表现出不同的敏感性,气流方向会导致触角不同方向的偏转。从头部前面施加的气流导致E区强烈激活,而C区几乎没有激活。从后面施加的气流表现出相反的结果。从头部侧面施加的气流导致C区同侧激活,E区对侧激活。不同的激活使果蝇能够感知风来自哪个方向。目前尚不清楚是相同的CE亚组神经元介导风和重力检测,还是存在对重力检测更敏感的CE神经元和对风检测不太敏感的CE神经元[14]。野生型果蝇能够感知重力的一个证据是,果蝇在试管中被摇晃后,会倾向于向上飞,抵消重力矢量的作用(负重力趋性)。当触角被切除时,这种负重力趋性行为消失,但趋光性行为(果蝇向光源飞去)没有消失。如果还去除第二节,即JO所在的地方,负重力趋性行为会再次出现。这表明,当JO缺失时,果蝇仍然可以通过其他器官感知重力,例如脖子或腿上的机械感受器。这些感受器已被证明在其他昆虫物种中负责重力感知[27]。
沉默特定神经元
[edit | edit source]可以使用破伤风毒素结合亚组特异性GAL4驱动子和微管蛋白-GAL80选择性地沉默JO神经元亚组。后者是一种温度敏感的GAL4阻断剂。通过这种方法,可以证实CE亚组的神经元负责重力趋性行为。消除CE亚组的神经元不会损害听觉能力[26]。沉默B亚组会损害雄性对求偶歌的反应,而沉默CE或ACE组不会[14]。由于发现A亚组参与听觉(见上文),因此这个结果出乎意料。从不同的实验中,研究了声音引起的复合动作电位(动作电位的总和),得出的结论是A亚组是纳米级接收器振动所必需的,这种振动是由求偶雄性的微弱歌声引起的。
如上所述,JO神经元解剖学上不同的亚组具有不同的功能[14]。这些神经元连接到相同的触角接收器,但它们在接收器上的连接位置相反。因此,例如对于向前摆动,一些神经元被拉伸,而另一些被压缩,这会导致不同的响应特征(相反的钙信号)。振动敏感神经元和偏转敏感神经元之间的差异可能来自不同的转导分子机制(即适应或非适应通道,以及NompC依赖或不依赖)。声音敏感神经元表达机械转导通道NompC(无机械感受器电位C,也称为TRPN1)通道,而CE亚组独立于NompC[14]。此外,AB亚组的JO神经元转导动态接收器振动,但对静态接收器偏转快速适应(即它们表现出相位反应)[28]。CE亚组的神经元在静态偏转期间表现出持续的钙信号响应(即它们表现出紧张反应)。这两种不同的行为表明存在具有不同适应特性的转导通道,这在哺乳动物耳蜗或哺乳动物皮肤(即紧张激活的默克尔细胞和快速适应的迈斯纳氏小体)中也是已知的[26]。
大脑中重力和声音感知的差异
[edit | edit source]A和B亚组的神经元靶向AMMC中初级听觉中心的区域,另一侧靶向腹外侧原脑(VLP)的下部(见图2B)。这些区域在自身之间以及与VLP之间表现出许多连合连接。对于CE亚组的神经元,几乎没有发现靶向区域之间的连合连接,也没有连接到VLP。与CE亚组区域相关的神经元从胸神经节下降或上升。AB和CE神经元投射的这种差异强烈地提醒了哺乳动物中听觉和前庭通路分离的脊椎动物投射[20]。
蜜蜂的约翰斯顿氏器
[edit | edit source]
蜜蜂的约翰氏器(JO)也位于触角柄上,用于探测近场声音[17]。在蜂巢中,一些蜜蜂会进行“摆尾舞”,据信这种舞蹈可以向同类传达食物来源的距离、方向和收益率信息。跟随者必须在蜂巢的黑暗中破译舞蹈信息,即视觉感知不参与此过程。声音感知可能是获取舞蹈信息的一种方式。跳舞的蜜蜂发出的声音载频约为 260 赫兹,是由翅膀振动产生的。蜜蜂拥有各种机械感受器,例如表皮上的毛发或眼睛上的刚毛。Dreller 等人发现,JO 中的机械感受器负责蜜蜂的声音感知[17]。然而,当振幅过低而无法使鞭毛振动时,毛发感受器可能仍然参与探测更远的声音源。Dreller 等人训练蜜蜂将声音信号与蔗糖奖励联系起来。训练蜜蜂后,对一些蜜蜂的不同机械感受器进行了去除。然后再次测试蜜蜂将声音与奖励联系起来的能力。操纵 JO 导致学习技能的丧失。训练可以用 265 赫兹的频率进行,也可以用 10 赫兹的频率进行,这表明 JO 也参与低频听觉。只有一根触角的蜜蜂犯的错误更多,但仍然比切除两根触角的蜜蜂好。每根触角中的两个 JO 可以帮助跟随者计算跳舞蜜蜂的方向。蜜蜂在其他情况下也可能使用听觉,例如保持蜂群聚集在一起。摆尾舞的破译不仅是通过听觉感知来完成的,而且也是或更多地通过电场感知来完成的。蜜蜂的 JO 允许探测电场[29]。如果身体部位一起移动,蜜蜂会在其表皮中积累电荷。昆虫对电场做出反应,例如通过改变运动方式(Jackson,2011)。表面电荷被认为在授粉中起作用,因为花通常带负电,而到达的花粉带正电[29]。这可以帮助蜜蜂采集花粉。通过训练蜜蜂识别静电场和调制电场,Greggers 等人证明蜜蜂可以感知电场[29]。跳舞的蜜蜂会产生电场,这会引起鞭毛的运动,其强度比仅由翅膀振动产生的机械刺激强 10 倍。蜜蜂的鞭毛振动通过 JO 进行监控,JO 对带电翅膀振动引起的位移幅度做出反应。这可以通过记录电场刺激期间来自 JO 轴突的复合动作电位响应来证明。没有触角,JO 无法接收电场。是否还有其他非触角机械感受器参与电场接收尚未排除。Greggers 等人的研究结果表明,电场(以及 JO)与蜜蜂的社会交流有关。
索顿氏器,如 JO,仅在昆虫和甲壳类动物中发现[15]。索顿氏神经元是纤毛细胞[30]。编码功能纤毛所需蛋白质的基因在索顿氏神经元中表达。人类同源基因的突变会导致遗传性疾病。了解纤毛发生的机制有助于了解和治疗由人类纤毛形成或功能缺陷引起的疾病。这是因为控制昆虫和脊椎动物神经元特化的过程基于高度保守的转录因子,以下示例说明了这一点:Atonal(Ato),一种前神经转录因子,指定索顿氏器的形成。小鼠直系同源基因 Atoh1 对于耳蜗中毛细胞的发育是必需的。表达 Atoh1 表型突变体(聋)的小鼠可以通过果蝇的 atonal 基因治愈。研究昆虫的索顿氏器可以让我们更深入地了解机械感觉和纤毛的构建。果蝇是研究索顿氏器的通用模型[31]。果蝇易于且廉价地培养,产卵量大,可以以多种方式进行基因改造,并且生命周期短,这使得可以在相对较短的时间内研究多个世代。此外,控制发育和生存的大多数基本生物机制和途径在果蝇和其他物种(如人类)中是保守的。虽然人类感觉系统为我们提供了感知运动和环境的惊人方式,但昆虫和蜘蛛的感觉系统也不逊色。举几个例子,蜘蛛最多有八只眼睛,有些蜘蛛的视力几乎与人类一样敏锐;蜜蜂在其他蜜蜂在蜂巢中跳舞时“感觉到节奏”,并从中了解到食物来源的位置;蚊子通过气味追踪猎物。此外,与哺乳动物相比,昆虫研究的伦理或方法学限制要少得多。尤其是在果蝇中,使用分子遗传工具,可以靶向任何基因(例如,敲除或过表达),并且该系统比人类更容易管理。
这本关于感觉系统的书籍主要介绍人类感觉系统,其中有一章介绍嗅觉系统,那么为什么我们需要关于昆虫嗅觉系统的一章呢?果蝇(drosophila melanogaster),我们将重点介绍它,是生物学中一个非常重要的模式动物,许多关于感觉系统的研究是在果蝇中进行的。视觉系统和嗅觉系统都得到了深入研究,并且伦理或方法学限制较少。使用分子遗传工具,可以靶向果蝇中的任何基因(例如,敲除或过表达),并且该系统比人类更容易管理。虽然嗅觉系统的功能与人类的嗅觉系统有很大不同,但我们仍然可以找到共同的原理。此外,昆虫嗅觉系统启发了机器人、医学和许多其他领域的工程学。

要理解气味感知的具体细节,必须意识到气味与其他刺激有很大不同。它与光和声音的不同之处在于,它不是通过波传播的,而是通过扩散、气流和湍流传播的。此外,虽然光和声音只有频率成分和振幅这两个感知相关特征,但气味具有各种各样的离散气味物质,以及更多可能的混合物,且浓度不同。


在昆虫(以及大多数脊椎动物)中,感觉系统对于定向和觅食至关重要,但也具有社会(例如蚂蚁的巢穴伙伴识别)和性(例如通过信息素寻找和选择配偶)意义。气味信息的主要路径从嗅觉感觉器(昆虫的感觉器官,其中包含感觉神经元)开始,大多数昆虫的嗅觉感觉器位于触角上,看起来像果蝇身上的小毛发(见图)。存在着各种各样的触角类型(不仅用于嗅觉),以及许多不同的感觉器类型。
为了理解一般原理,以黑腹果蝇的棒状感觉毛为例就足够了。气味分子通过角质层的裂缝或孔进入到水性的感觉毛淋巴液中,在那里,一些类型的分子与气味结合蛋白结合,并被携带着向嗅觉受体神经元 (ORN) 的树突移动,另一些则在淋巴液中扩散到树突。在树突的膜上,存在着与气味分子结合的嗅觉受体 (OR),它们负责将信号转化为膜电流。该电流通过树突传播到细胞体,在那里 (在轴突丘),产生动作电位。动作电位沿着 ORN 的轴突传播到触角叶 (相当于脊椎动物的嗅球),在那里,ORN 与局部中间神经元和投射神经元形成突触。触角叶被组织成所谓的嗅球。目前尚不清楚它们是如何参与模式识别的,但嗅球的激活模式可以提供有关呈现给果蝇的气味的信息。
投射神经元投射到侧角 (可能在那里处理先天的气味反应) 和蘑菇体中的肯尼恩细胞。蘑菇体是昆虫脑中的神经元丛,因其形状类似蘑菇而得名。在那里,气味与其他感觉方式和行为相关联,这就是为什么蘑菇体是研究学习和记忆的重要模型系统。
ORN 中的气味受体
[edit | edit source]
昆虫的嗅觉感觉毛包含一个或多个嗅觉受体神经元,它们将气味信息转化为电信号 (动作电位)。大多数 ORN 只包含一种受体类型,但每种受体类型对多种气味都有反应 (见图)。然而,也有一些受体更特异,因为它们检测到的气味在昆虫的行为中起着重要的作用或在化学上是独特的。一个更特异受体的例子是二氧化碳受体。其他气味只能微弱地激活它,并且它会直接触发果蝇的回避反应 [32]。ORs 的特异性是由于气味对受体的亲和力不同。亲和力越高,当施加气味时,被占用的受体越多,电流反应越强。然而,ORN 对刺激的反应并非线性。可以假设大多数 ORN 在其工作范围内呈对数反应,这增加了它们的动态范围。对数关系不适用于低于各自检测阈值的刺激以及饱和状态。大多数 ORN 表现出相位-强直的开启反应,即它们在呈现刺激时会以强烈的放电速率增加进行反应,如果刺激持续存在,则会显示放电速率适应。
嗅觉受体是膜蛋白,当气味分子与其结合时,会通过膜引发离子电流。在嗅觉系统中,这可以通过两种方式实现:代谢型和离子型受体。在哺乳动物中,嗅觉受体是已知的代谢型 G 蛋白偶联受体,它们释放进入细胞的 G 蛋白,通过短的细胞内信号级联激活离子通道。相比之下,昆虫中的大多数嗅觉受体是离子型受体,它们是当气味分子结合时打开的离子通道。通过节省信号级联的时间,离子型受体比代谢型受体快得多 [33]。
气味信息处理
[edit | edit source]到达触角的气味包含不同的信息部分:一方面是气味的身份,即它是哪种气味或混合物,另一方面是成分的量。此外,刺激的时间包含信息。如果两种气味例如同时开始,则很可能它们属于同一个物体。研究表明,昆虫确实利用气味时间信息不仅来检测气味来源的方向,而且还来区分和追踪气味物体 [34][35][36]。使这种行为成为可能的处理机制尚不清楚,但令人惊讶的是,即使是几毫秒范围内的刺激开始延迟也可能是有用的。最近的研究结果表明,昆虫嗅觉系统的速度和时间分辨率非常出色,远远超过预期。
通过钙成像 (一种通过荧光标记可视化细胞质钙从而可视化神经元活动的方法),可以创建触角叶的功能图谱。基本上,所有包含一种 OR 的一种受体神经元类型的 ORN 都投射到一个嗅球。因此,(在果蝇中大约 54 个) 每个嗅球都将一种受体类型的反应联合起来,形成一个空间模式。然而,研究表明,嗅球反应的时间动力学也被用来编码信息 [37]。因此,气味信息通过时空放电模式在嗅觉系统中编码 [38]。
到目前为止,还没有办法像理解视觉和听觉系统那样,理清和理解气味代码。这可能是由于上面讨论的气味的特殊性。神经元没有容易映射的拓扑结构组织,因为气味空间是多维的并且不连续。
嗅球活动模式在蘑菇体中与行为相关联。大多数昆虫在那里表现出高度的可塑性,例如,蜜蜂能够在仅仅几次呈现后将气味与食物奖励联系起来。据说蘑菇体中的气味信息由稀疏代码表示,这意味着只有少数肯尼恩细胞以很少的峰值响应。相比之下,上面描述的触角叶和 ORN 中的代码是组合代码。
气味感知和行为意义
[edit | edit source]对于昆虫来说,嗅觉系统具有重要的行为意义。例如,正如我们所有人可能都亲身经历过的那样,蚊子可以通过气味追踪它们的受害者。蚂蚁沿着信息素痕迹追踪到食物来源,但也能够通过群体特有的碳氢化合物谱识别它们的巢友 (因此能够在它们的领地内消灭敌人和小偷)。许多飞蛾利用性信息素寻找交配对象。
通常,自然界中的气味不是纯净的化学物质,而是混合物。然而,这些混合物被感知为一个整体,并且与行为直接相关。触角叶中混合物的**神经元反应**不能总是通过对成分的反应来预测 [39]。因此,不应该想当然地认为嗅觉系统像电子鼻一样工作,电子鼻旨在分析所呈现气味的成分。此外,与视觉相比,视觉信息需要经过深入处理,直到内容的相关性变得明显,嗅觉系统更强烈、更直接地与行为 (以及至少在高级动物中与情绪) 相关联。这些连接有时是先天的,但通常也是学习的和特质的。
参考文献
[edit | edit source]- ↑ F. G. Barth: A Spider´s World: Senses and Behavior. ISBN 978-3-642-07557-5, Springer-Verlag Berlin, Heidelberg. (2002)
- ↑ D. P. Harland, R. R. Jackson: 'Eight-legged cats' and how they see - a review of recent research on jumping spiders (Araneae: Salticidae). Department of Zoology, University of Canterbury (2000)
- ↑ A. Schmid: Different functions of different eye types in the spider Cupiennius salei. The Journal of Experimental Biology 201, 221–225 (1998)
- ↑ S. Yamashita, H. Tateda: Spectral Sensitivities of Jumping Spider Eyes. J. comp. Physiol. 105, 29-41 (1976)
- ↑ D. P. Harland, R. R. Jackson: Influence of cues from the anterior medial eyes of virtual prey on Portia fimbriata, an araneophagic jumping spider. The Journal of Experimental Biology 205, 1861–1868 (2002)
- ↑ A. Schmid, C. Trischler: Active sensing in a freely walking spider: Look where to go. Journal of Insect Physiology 57 p.494–500 (2011)
- ↑ D. B. Zurek, X. J. Nelson: Hyperacute motion detection by the lateral eyes of jumping spiders. Vision Research 66 p.26–30 (2012)
- ↑ D. B. Zurek, A. J. Taylor, C. S. Evans, X. J. Nelson: The role of the anterior lateral eyes in the vision-based behaviour of jumping spiders. The Journal of Experimental Biology 213, 2372-2378 (2010)
- ↑ F. M. G. da Costa, L. da F. Costa: Straight Line Detection as an Optimization Problem: An Approach Motivated by the Jumping Spider Visual System. In: Biologically Motivated Computer Vision, First IEEE International Workshop, BMVC 2000, Seoul, Korea (2000)
- ↑ G.W. Uetz, E. I. Smith: Asymmetry in a visual signaling character and sexual selection in a wolf spider. Behav Ecol Sociobiol (1999) 45: 87–93
- ↑ D. P. Harland, R. R. Jackson: Influence of cues from the anterior medial eyes of virtual prey on Portia fimbriata, an araneophagic jumping spider. The Journal of Experimental Biology 205, 1861–1868 (2002)
- ↑ R. R. Jackson, D. P. Harland: One small leap for the jumping spider but a giant step for vision science. THE JOURNAL OF EXPERIMENTAL BIOLOGY, JEB Classics p.2129-2132
- ↑ P. M. de Omena 和 G. Q. Romero:利用微生境特征的视觉线索寻找家园:以凤梨科植物栖息跳蛛 (Salticidae) 为例。 行为生态学 21:690–695 (2010)
- ↑ a b c d e f g h i Kamikouchi A, Inagaki HK, Effertz T, Hendrich O, Fiala A, Gopfert MC, Ito K (2009). "果蝇重力感应和听觉的神经基础"。自然. 458 (7235): 165–171。
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ a b c d Yack JE (2004). "昆虫听觉索状体的结构和功能"。显微镜研究与技术. 63 (6): 315–337。
- ↑ 约翰斯顿,克里斯托弗。1855. 原始通讯:库蚊的听觉器官
- ↑ a b c Dreller C 和 Kirchner WH (1993). "蜜蜂的听觉:听觉感觉器官的定位"。比较生理学杂志 A. 173: 275–279。
- ↑ McIver, S.B. 1989. 机械感受,在昆虫生理学、生物化学和药理学全书中。 培格蒙出版社。 1989,第 6 卷,第 71-132 页。
- ↑ Keil,Thomas A. 1999. 第 1 章 - 外周嗅觉器官的形态和发育。 [书作者] B.S. Hansson. 昆虫嗅觉。 : 施普林格,1999,第 5-48 页
- ↑ a b c d e Jarman,Andrew P. 2014. 第 2 章 - 果蝇听觉器官(约翰斯顿器官)的发育。 听觉和前庭系统发育(第四版)。 圣地亚哥 : 学术出版社,2014,第 31-61 页
- ↑ Baker,Dean Adam 和 Beckingham,Kathleen Mary 和 Armstrong,James Douglas。 2007. 果蝇黑腹果蝇重力迷宫行为的神经基质的功能解剖。 比较神经学杂志。 2007,第 501 卷,第 5 期,第 756-764 页
- ↑ Nadrowski,Björn 和 Albert,Jörg T. 和 Göpfert,Martin C (2008). "基于换能器的力产生解释了果蝇听觉中的主动过程"。当代生物学. 18 (18): 1365–1372。
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ a b c Kamikouchi A, Shimada T 和 Ito K (2006). "果蝇黑腹果蝇脑中听觉感觉投射的全面分类"。J. 比较神经学. 499 (3): 317–356。
- ↑ Tauber,Eran 和 Eberl,Daniel F. 2003. 果蝇的声学交流。 行为过程。 2003,第 64 卷,第 2 期,第 197-210 页
- ↑ Baker,Dean Adam 和 Beckingham,Kathleen Mary 和 Armstrong,James Douglas。 2007. 果蝇黑腹果蝇重力迷宫行为的神经基质的功能解剖。 比较神经学杂志。 2007,第 501 卷,第 5 期,第 756-764 页
- ↑ a b c d e Yorozu S, Wong A, Fischer BJ, Dankert H, Kernan MJ, Kamikouchi A, Ito K, Anderson DJ (2007). "果蝇脑中风和近场声音的不同感觉表征"。自然. 458 (7235): 201–205。
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Beckingham,Kathleen M. 和 Texada,Michael J. 和 Baker,Dean A. 和 Munjaal,Ravi 和 Armstrong,J. Douglas。 2005. 动物重力感知的遗传学。 学术出版社。 2005,第 55 卷,第 105-145 页
- ↑ Nadrowski,Björn 和 Albert,Jörg T. 和 Göpfert,Martin C. 2008. 基于换能器的力产生解释了果蝇听觉中的主动过程。 当代生物学。 2008,第 18 卷,第 18 期,第 1365-1372 页
- ↑ a b c Greggers U, Koch G, Schmidt V, Dürr A, Floriou-Servou A, Piepenbrock D, Göpfert MC, Menzel R (2013). "蜜蜂对电场的接收和学习"。英国皇家学会会刊 B: 生物科学. 280: 1759。
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Kavlie,Ryan G. 和 Albert,Jörg T. 2013. 索状体。 当代生物学。 2013,第 23 卷,第 9 期,第 334-335 页
- ↑ Jennings,Barbara H. 2011. 果蝇,生物学和医学中通用的模型。 材料今日。 2011,第 14 卷,第 5 期,第 190-195 页
- ↑ Suh GS, Ben-Tabou de Leon S, Tanimoto H, Fiala A, Benzer S, Anderson DJ: 果蝇中先天性嗅觉回避反应的光激活。 Curr Biol 2007, 17:905-908。
- ↑ Silbering AF, Benton R (2010) 化学感受中的离子型和代谢型机制:'偶然还是设计'? EMBO 报告 11:173-179。
- ↑ Baker TC, Fadamiro HY, Cosse AA (1998) 蛾子使用微调来分辨气味。 自然 393:530-530。
- ↑ Justus KA, Schofield SW, Murlis J, Carde RT (2002) 仓储螟雄虫在快速脉冲型性信息素羽流中的飞行行为。 昆虫生理学 27:58-66。
- ↑ Szyszka P, Stierle JS, Biergans S, Galizia CG (2012) 嗅觉的速度:毫秒内气味-物体分离。 PloS one 7:e36096。
- ↑ DasGupta S, Waddell S (2008) 果蝇中学习到的气味辨别,没有触角叶中的组合气味图。 当前生物学 : CB 18:1668-1674。
- ↑ Brown, S. L., Joseph, J., & Stopfer, M. (2005). 使用时间结构化神经表征编码时间结构化刺激。 自然神经科学,8(11), 1568-1576。
- ↑ Silbering, A. F., & Galizia, C. G. (2007). 果蝇触角叶中气味混合物的处理揭示了全局抑制和特定球状体的相互作用。 神经科学杂志,27(44), 11966-11977。
平衡棒(果蝇的陀螺仪)
[edit | edit source]
平衡棒是许多飞行昆虫中存在的感官器官。人们普遍认为,平衡棒是这些昆虫后一对翅膀的进化修改,它提供陀螺仪感官数据,这对飞行至关重要。尽管苍蝇有其他相关的系统来帮助飞行,但苍蝇的视觉系统太慢,无法进行快速机动。此外,为了能够在弱光条件下熟练地飞行,避免捕食的必要条件,需要这样的感官系统。事实上,没有平衡棒,苍蝇就无法进行持续、受控的飞行。自 18 世纪以来,科学家们就意识到了平衡棒在飞行中所起的作用,但直到最近,它们的操作机制才得到更好的探索。 [1] [2]
平衡棒由两对翅膀中最靠后的那一对进化而来。虽然第一对翅膀保持了它的飞行功能,但后一对翅膀已经失去了它的飞行功能,并采用了略微不同的形状。从视觉上看,平衡棒由三个结构部件组成:一个球形末端、一个细长的柄和一个稍宽的基部。球形末端包含大约 13 根神经支配的毛发,而基部包含两个弦音器官,每个器官都由大约 20-30 根神经支配。弦音器官被认为是仅对拉伸有反应的感觉器官,尽管它们仍然相对未知。基部还覆盖着大约 340 个杯状感觉器,它们是沿着它们被拉伸的方向优先响应压缩的小纤维。这些纤维中的每一个也受到神经支配。相对于平衡棒的柄,弦音器官和杯状感觉器都具有大约 45 度的方位,这对于测量平衡棒上的弯曲力是最佳的。平衡棒在飞行过程中与翅膀反向(反相)运动。感官组件可以分为三组 [3]): 对平衡棒垂直振动敏感的那些,包括背侧和腹侧肩胛骨板、背侧和腹侧希克斯乳突(板和乳突都是前面提到的杯状感觉器的子类别)以及小的弦音器官。基底板(感觉器的另一种表现形式)和大的弦音器官对作用在平衡棒上的陀螺力矩敏感,并且还存在一个对作用在平衡棒基部的所有应变有反应的未分化乳突群。这为苍蝇提供了另一种方法来区分施加在平衡棒上的力的方向。
随着同源异型基因被发现和探索,人们发现,删除或失活同源异型基因超双胸基因 (Ubx) 会导致平衡棒发育为正常的一对翅膀。这是一个关于同源异型基因本质的非常有说服力的早期结果。对触角基因的操作同样会导致腿部严重变形,或者会导致头部出现一套腿部而不是触角。
平衡棒通过检测科里奥利力来发挥作用,感知空气在可能旋转的苍蝇身体上的运动。研究表明,身体的角速度是由平衡棒测量的科里奥利力编码的 [3]。活动的平衡棒可以招募任何相邻的单位,影响附近的肌肉,并导致飞行动力学的巨大变化。平衡棒已被证明具有极快的响应时间,允许这些飞行变化比苍蝇依靠视觉系统更快地执行。为了区分不同的旋转成分,如俯仰和滚动,苍蝇必须能够组合来自两个平衡棒的信号,这些信号不能是重合的(重合信号会降低苍蝇区分旋转轴的能力)。平衡棒能够有助于图像稳定,以及飞行姿态控制,这已由许多作者通过注意到头部和翅膀对旋转速率向量分量的输入的反应来证实。平衡棒对头部和颈部运动的贡献已被注意到,解释了它们在注视稳定中的作用。因此,苍蝇利用来自平衡棒的输入来确定将目光固定在何处,这是一种有趣的感觉整合。
记录表明,平衡棒能够以与科里奥利力相同的频率(双翼拍打)响应刺激,这一概念证明了这些测量如何发生的进一步数学分析。平衡棒的角速度与身体旋转的向量叉积为苍蝇提供了科里奥利力向量。这种力在俯仰和平面上的频率与翼拍频率相同,而在偏航平面上的频率是其两倍。平衡棒能够提供速率阻尼信号以影响旋转。这是因为科里奥利力与苍蝇自身的旋转速率成正比。通过测量科里奥利力,平衡棒可以向其相关的肌肉发送适当的信号,从而使苍蝇能够适当地控制其飞行。平衡棒的大幅度运动允许计算旋转的垂直和水平速率。由于平衡棒在垂直运动和水平运动之间的巨大差异,Ω1,旋转速率的垂直分量,产生的力是水平分量频率的两倍。人们普遍认为,这种两倍的频率差异是苍蝇区分垂直和水平分量的原因。如果我们假设平衡棒以正弦方式运动,这是对其真实世界行为的相当准确的近似,则角位置 γ 可以建模为: 其中 ω 是平衡棒的拍打频率,振幅为 180,接近于现实中的运动范围。已知速率(滚动、俯仰和平面分量分别用 1、2 和 3 标记)可以计算身体旋转速度,来自两个平衡棒的(Ωb 是左侧,Ωc 是右侧平衡棒)参考系,相对于苍蝇的身体,使用以下计算 [2]
α 代表平衡棒相对于身体平面的旋转角度,Ω 项是指平衡棒相对于身体的角速度。了解这一点后,可以粗略地使用平衡棒末端球形体上的力方程来模拟对平衡棒的输入
m 是平衡棒的球形末端的质量,g 是重力加速度,ri、vi 和 ai 分别是球形末端相对于苍蝇身体在i 方向上的位置、速度和加速度,aF 是苍蝇的线性加速度,Ωi 和 Ώi 分别是苍蝇在空间中i 方向上的角速度和角加速度分量。科里奥利力由 2mΩ × vi 项模拟。由于产生的感觉信号与作用在平衡棒上的力成正比,因此这将允许模拟平衡棒信号。如果试图将力方程与旋转分量方程相协调,值得记住的是必须分别计算两个平衡棒的力方程。
参考文献
[edit | edit source]- ↑ J. L. Fox and T. L. Daniel (2008), "A neural basis for gyroscopic force measurement in the halteres of Holorusia.", J Comp Physiol, 194: 887–897
- ↑ a b Rhoe A. Thompson (2009), "Haltere Mediated Flight Stabilization in Diptera: Rate Decoupling, Sensory Encoding, and Control Realization.", PhD thesis, University of Florida
- ↑ a b J. W. S. Pringle (1948), "The gyroscopic mechanism of the halteres of diptera.", Phil Trans R Soc Lond B, 233 (602): 347–384
昆虫导航中的空间记忆
[edit | edit source]一些昆虫对地点有着惊人的记忆力。蟋蟀会记住在一个原本炎热区域中的一个凉爽地点的位置。寄生蜂 (Argochrysis armilla) 可以记住另一个膜翅目昆虫 (Ammophila pubescens) 在哪里挖掘了它不显眼的小窝,以便以它的幼虫为食。为了帮助其他蜜蜂找到回巢的路,Partamona batesi 进化出了一种复杂的行为,即把白色的河沙粘在一起,形成一个明显可见的门廊。所有这些不同的行为都有一个共同点,即昆虫对周围环境有感知,并且能够在其中导航。空间记忆在各种以中央地点觅食为食的昆虫的行为中都有体现。记住位置对于寻找和记住资源丰富的食物地点、返回巢穴或在流动的水域或空中保持位置至关重要 [5]。
直到最近,行为实验主要在群居蜜蜂和蚂蚁上进行,并且在简化的环境中进行(减少了地标数量,并根据所提问题改变了全景),以揭示三种不同类型的基于记忆的引导机制 [5]。虽然两种机制基于对周围环境的记忆,但第三种机制是基于一个内部累加器,从巢穴到所需地点创建一个矢量 [2][3][4][5][7][12][13]。
- 对齐图像匹配 用于沿着熟悉的路线前进,将记忆中的快照视图与当前的景象进行比较 [5][10]。
- 位置图像匹配 是一种更普遍的定位方式,用于目标地点已知,但起点或路线未知的情况 [1][5][13]。
- 路径积分 在感知的环境未知或穿过没有特征的景观时发挥作用。昆虫测量距离和方向,创建一个矢量 [2][5]。
昆虫使用所有三种程序,将它的感官输入与所需感官输入的记忆进行比较。这些输入的差异被转化为一个“输出矢量”,指向目标地点 [4][5]。根据情况,并非所有机制都需要同时使用。通过三种不同过程的融合和互补,可以在多种条件下实现定向 [4][5]。
对齐图像匹配
[edit | edit source]对齐图像匹配是将视觉输入与记忆进行比较的最基本方式。它用于沿着已知路线行驶。这样做,将当前的视网膜图像与视觉记忆进行比较并使之一致 [10]。
质量分数位置、定向边缘和分割
[edit | edit source]Lent 等人观察了红林蚁 (Formica rufa) 在人工场景中的行为,比较了它们在原始场景和改变后的场景中所走的路线。该研究小组发现了几种不同的行为,这些行为帮助蚂蚁选择方向。其中一个过程类似于蚂蚁已知的计算形状质心的能力。研究发现,蚂蚁利用“质量分数位置”(FPM)进行定向,这使得蚂蚁能够在距离形状几米的位置进行稳健的定向。FPM 是蚂蚁前进的方向,由形状左右区域的比例描述(图 1)。此外,研究发现,昆虫通过提取局部视觉特征(如定向边缘,例如形状的斜边)并将其叠加在视觉记忆上进行定向 [8][10]。此外,蚂蚁似乎会分割复杂的场景,分别计算每个部分的 FMP。在简单的场景中,对整个图像计算一个 FPM [10]。
为了获得最佳的引导效果,研究发现,蚂蚁首先通过局部特征进行定向。最近的一项研究表明,蚂蚁可能会分割它们的视野并计算相应的 FPM。如果昆虫偏离了它们最初的方向,则通过扫视样旋转实现身体方向的校正 [10]。实验表明,红林蚁每三秒进行一次这种对齐,必要时在方向上最多校正 70 度 [5]。
地标和天际线
[edit | edit source]可靠地标的特点是,它在多次旅程中都可用,并且在各种不同的光照条件下都可见(图 2)。Graham 和 Cheng 认为天际线就是一个值得信赖的地标。天际线轮廓是指与天空形成对比的地面上的物体 [7]。他们的实验使用的是所谓的零矢量蚁。零矢量蚁是在进入蚁巢前捕获的。因此,它们缺乏路径积分矢量(设置为零),并且在被转移后只能依靠视觉线索进行导航。Graham 和 Chen 研究了蚂蚁在被转移后如何成功地返回蚁巢。此外,还测试了这种行为在改变的环境中,即使用人工全景以及它的几个侧向平移版本。他们发现,蚂蚁会根据虚假的天际线改变方向,独立于内部指南针机制 [7]。

其他研究人员将无所不在的天际线与其他地标区分开来。Wystrach 等人观察到,蚂蚁 (Melophorus bogati) 的引导不能完全通过仅利用地标进行定向来解释。由于蚂蚁的眼睛分辨率很差,因此会降低复杂的自然景观,因此有人提出,全景或天际线视图被用于基本定向,提供主要的粗略方向提示 [12]。
位置图像匹配
[edit | edit source]位置图像匹配描述了一种更普遍的视觉记忆利用方式。与对齐图像匹配相比,只要存在足够多的熟悉元素,这个过程允许从新的、未知的位置通过新方向引导到所需的目标 [5]。在杂乱的环境中,蚂蚁严重依赖它们的路径积分矢量和周围的地标。如果它们在熟悉的地形中,有足够的地标,那么路径积分矢量就会被忽略,昆虫就会依靠快照 [1][13]。在模拟中,一个执行图像匹配的机器人表现出与蚂蚁相似的行为,这表明蚂蚁可能使用了这种过程 [11]。
天际线高度、视觉指南针和失配梯度下降
[edit | edit source]Wystrach 等人提出了三种额外的视图匹配策略。首先,他们建议蚂蚁将当前位置的天际线高度与目标场景视图记忆进行比较。如果当前状态的天际线过高,则蚂蚁需要沿着当前视线方向行走。相反,如果天际线过低,则蚂蚁需要偏离当前朝向方向(图 3)。尽管该模型总体上具有鲁棒性,但它有两个缺陷。首先,两个视图之间的高度差必须足够大才能区分。其次,蚂蚁必须与记忆视图具有相同的绝对方向才能成功比较两个天际线。但是,这可以通过地磁或天体罗盘来实现。因此,天际线高度比较是获得新位置的粗略航向方向的良好工具,但在接近目标时几乎不可行[13]。

其次,他们提出蚂蚁拥有一个视觉罗盘,它需要记忆在面对巢穴时围绕巢穴拍摄的几个不同视图。如果昆虫发现自己处于未知位置,它可以将当前视图与记忆视图进行比较,选择最佳匹配的视图并计算出航向方向。该模型得到了观察结果的支持,即Ocymymex 蚂蚁执行精心编排的学习行走,其中也包括面对巢穴。与天际线高度比较相比,蚂蚁在寻找适当方向方面没有问题,因为它们的记忆视图已经指向巢穴。但是,如果保留的巢穴记忆视图不是最佳匹配,蚂蚁可能会被引导到完全错误的方向。这意味着使用视觉罗盘在熟悉的路线中是一个非常稳健的模型,但它不适用于从不熟悉的位置找到通往巢穴的路线[13]。
第三种提出的过程称为失配梯度下降,它提供了方向。感知图像和记忆图像不断进行比较。为了使该过程起作用,蚂蚁需要三维信息,这些信息需要通过斜向穿过景观来获取。然而,这尚未被观察到,这导致了一个结论,即仅靠失配梯度下降不会将蚂蚁引导到想要的目标[13]。
这些发现表明,天际线高度比较应用于查找航向方向。失配梯度下降帮助蚂蚁在行走过程中记住通往巢穴的方向,一旦靠近巢穴,视觉罗盘就会将蚂蚁引导到它的家园。所有不同的模型都可以混合使用,它们的相对贡献可能有所不同[13]。如果上述机制都没有指示航向方向,即如果昆虫处于完全陌生的环境中,蚂蚁将从系统搜索开始,搜索包括循环,这些循环随着搜索过程中的时间推移而增加大小[13]。
位移后迷茫
[edit | edit source]研究表明,在沿着路线进行训练后,零向量蚂蚁在被从家门口拾起并替换到喂食器后,会表现出短暂的迷茫阶段,表现为无定向的行走。似乎在迷茫期间忽略了通往巢穴的路线记忆。很明显,路线的重复导致动物的迷茫,让人不禁要问,它们是否拥有类似情景的记忆,告诉它们已经走过这条路线[4]。然而,并非总是能观察到这种迷茫,尤其是在杂乱的环境中。这可以通过这样的假设来解释,即蚂蚁在杂乱的环境中将自己的视野分成几个阶段。当被移动时,蚂蚁可能认为它们仍在通往巢穴的路上,因为路线的最后阶段尚未到达[4]。
路径积分
[edit | edit source]路径积分是一种航位推算,其中通过测量方向、速度和所用时间来进行持续定位[2][5]。这需要累加器作为整个系统的核心组件[6]。因此,蚂蚁获得了一个向量,它表示相对于巢穴位置的移动距离和方向[5]。为了了解到达目标地点的航向,通过从目标地点的路径积分状态记忆中减去当前路径积分状态来生成输出向量[4][5]。
构建路径积分向量
[edit | edit source]为了构建向量,昆虫需要一个起点。该模型的惯例是将巢穴作为原点,定义为零[6]。向量方向必须相对于外部或内部线索进行。外部线索是太阳罗盘、大型地标或偏振光[3]。如果环境中没有用于导航的线索,则使用内部线索,例如对地球磁场的感知[2][3][5]。蜜蜂通过测量使用光流所走的距离来确定向量的长度。蚂蚁通过从它们的步伐中获得的本体感受输入来做到这一点[2][5]。
蚂蚁在无特征环境中完全依赖路径积分
[edit | edit source]由于方向的算术方法,使用路径积分的昆虫可以在完全陌生的地形中移动。这有助于动物穿越无特征的环境,并在探索之旅后返回巢穴[5]。
Collett 和 Collett 展示了一个简单的实验,证明蚂蚁完全依赖路径积分。返回的蚂蚁在到达目标之前被置于熟悉的或未知区域。在这两种情况下,蚂蚁都会继续沿其路线行走,直到到达它们本应到达巢穴的点。只有在那时,它们才开始表现出搜索行为[6]。

路径积分是一个数学和认知挑战
[edit | edit source]除了跟踪当前位置的累加器之外,使用路径积分的昆虫还需要一些机制来存储目标地点的路径积分状态(例如,在觅食地),以便以后记住。总共需要记住四个因素:路径积分的当前状态、目标的路径积分状态、比较器的输出和输出向量。虽然这种制导系统显然基于向量计算,但目前还没有发现可以处理这种计算的神经回路[6]。
路径积分的两种主要模型
[edit | edit source]路径积分目前已知有两种主要模型。第一个模型假设累加器不断更新,而第二个模型假设累加器间歇更新。在累加器连续更新模型中,返回时的累加器状态必须与离开巢穴时的状态相同。因此,坐标系是封闭的。在间歇更新模型中,累加器状态在巢穴和蚂蚁转身返回的点被重置。为了返回,罗盘的极性被反转,蚂蚁朝着相反向量的方向前进,因此系统是开放的。研究表明,后者模型更可能是正确的,因为外向和内向向量不必完全抵消,这留下了小的误差空间[6]。
如上所述,昆虫在导航过程中不仅依赖路径积分。基于地标的图像匹配是熟悉路线方向的主要方式。路径积分和图像匹配独立工作,但也相互作用,相互调整。在路径积分引导的行走过程中,可以学习新的地标。而在图像匹配的行走过程中,可以对导航向量进行标准化[6]。
昆虫导航对于机器人开发者来说也非常有趣。已经有几个机器人使用路径积分作为其主要导航系统之一。这也是无人驾驶汽车应用的原理[2][3][11]。Lambrinos等人建造了一个名为“Sahabot”的机器人,它根据路径积分和基于视图的匹配来定位自身[9]。在开阔区域的导航似乎比在杂乱的环境中要简单,这仍然是研究的热点[2]。该研究领域不仅推动了机器的发展,而且有助于更好地理解人类的定位。路径积分原理应用于盲人、前庭缺陷患者的导航以及理论工作[2]。
为了实现正确且平稳的定位,记忆与学习相一致。昆虫必须学习目标的位置及其路线。还可以从其他个体那里学习其他路线。可能是展示这种行为的最著名例子是蜜蜂(Apis mellifera)[5]。
尽管有三种不同的定向机制,但昆虫似乎缺乏认知地图。事实上,当考虑路径积分时,是否反对这种地图存在证据是值得商榷的[5]。然而,应该牢记的是,昆虫的认知地图可能基于尚未了解的机制[5]。学习和认知地图的讨论在这里没有涉及,但可能对进一步回顾感兴趣。
[1] Akesson, S., & Wehner, R. (2002). 沙漠蚂蚁Cataglyphis \newblock fortis的视觉导航:快照是否与天体参考系耦合?J Exp Biol, \newblock 205(Pt 14), 1971-1978.
[2] Cheng, K., & Freas, C. A. (2015). 路径积分、视图、搜索和匹配滤波器:鲁迪格·韦纳对定向和导航研究的贡献。J Comp Physiol A Neuroethol Sens Neural Behav Physiol, 201(6), 517-532. doi:10.1007/s00359-015-0984-9
[3] Cheng, K., & Newcombe, N. S. (2005). 空间定向是否有几何模块?理论与证据的整合。Psychon Bull Rev, 12(1), 1-23.
[4] Collett, M. (2014). 沙漠蚂蚁对近期视觉体验的记忆和路线引导的控制。Proc Biol Sci, 281(1787). doi:10.1098/rspb.2014.0634
[5] Collett, M., Chittka, L., & Collett, T. S. (2013). 昆虫导航中的空间记忆。Curr Biol, 23(17), R789-800. doi:10.1016/j.cub.2013.07.020
[6] Collett, M., & Collett, T. S. (2000). 昆虫如何利用路径积分进行导航?Biol Cybern, 83(3), 245-259. doi:10.1007/s004220000168
[7] Graham, P., & Cheng, K. (2009). 蚂蚁在导航过程中使用全景天际线作为视觉线索。Curr Biol, 19(20), R935-937. doi:10.1016/j.cub.2009.08.015
[8] Harris, R. A., Graham, P., & Collett, T. S. (2007). 导航木蚁检索地标记忆的视觉线索。Curr Biol, 17(2), 93-102. doi:10.1016/j.cub.2006.10.068
[9] Lambrinos, D., Moller, R., Labhart, T., Pfeifer, R., & Wehner, R. (2000). 使用昆虫策略进行导航的移动机器人。Robotics and Autonomous Systems, 30(1-2), 39-64. doi:Doi 10.1016/S0921-8890(99)00064-0
[10] Lent, D. D., Graham, P., & Collett, T. S. (2013). 导航木蚁的视觉场景感知。Curr Biol, 23(8), 684-690. doi:10.1016/j.cub.2013.03.016
[11] Moller, R. (2000). 具有模拟处理的机器人的昆虫视觉归巢策略。Biological Cybernetics, 83(3), 231-243. doi:Doi 10.1007/Pl00007973
[12] Wystrach, A., Beugnon, G., & Cheng, K. (2011). 地标或全景:导航蚂蚁使用什么来进行引导?Front Zool, 8, 21. doi:10.1186/1742-9994-8-21
[13] Wystrach, A., Beugnon, G., & Cheng, K. (2012). 蚂蚁可能在路线内外使用不同的视图匹配策略。J Exp Biol, 215(Pt 1), 44-55. doi:10.1242/jeb.059584

视觉系统赋予动物感知环境的能力。这种对食物来源或危险的快速感知在所有物种中都很重要。黑腹果蝇(见图1)属于无脊椎动物,是该类群重要的模式生物。果蝇与人类等脊椎动物一样,具有视觉能力。将无脊椎动物(图2)的视觉系统与脊椎动物的视觉系统进行比较,发现它们在总体结构和架构上有很多相似之处,但也存在差异。确切的分子机制尚未完全了解,但在物种之间似乎存在保守机制。

将讨论两篇关于果蝇视觉系统的论文(S. Hakeda-Suzuki, T. Suzuki (2014) 和 Zipursky (2010)),以获取关于一般结构以及与脊椎动物视网膜差异和相似性的信息。将以R7和R8感光细胞为例,解释特定靶向感光细胞的不同步骤。

果蝇属于无脊椎动物,拥有复眼,约有750个小眼(图3)。一个小眼包含8个感光细胞(R1 - R8),它们表达不同的视紫红质,从而在功能上有所不同。R1 - R6感光细胞感知有关运动的信息。它们表达视紫红质Rh1,对可见光谱有广泛的反应。R7和R8负责色觉。R7表达对紫外线敏感的视紫红质Rh3/ Rh4,而R8表达Rh5/ Rh6。750个小眼中的每一个都包含所有8个感光细胞,以高度特定的方式排列。R1 - R6环绕着中心R7和R8感光细胞。激活感光细胞的传入信息被转发到视叶,视叶由四个不同的部分组成:小叶、髓质、小叶球和小叶板。
小叶被组织成径向不同的区域,称为小柱。复眼的曲率导致外感光细胞R1 - R6感知不同空间位置的信息。为了解释这种现象并提高灵敏度,来自不同相邻小眼的R1 - R6感光细胞被引导到小叶内同一个小柱。这使得保持视网膜对应关系成为可能。这个过程称为神经叠加。R7和R8不存在视网膜对应关系的问题,因为它们位于小眼的中心。R1 - R6感光细胞终止于小叶,并通过形成突触与小叶神经元连接。这些小叶神经元将信息转发到髓质。R7和R8在小叶中不形成突触,并进一步投射到髓质。
髓质由十个不同的层M1 - M10组成,并且被径向地分为柱。R7专门投射到M6层,而R8投射到M3层。来自同一小眼(视网膜)的R7和R8以及来自同一小柱(小叶)的小叶神经元靶向髓质中的同一柱。小叶神经元也表现出定型的连接模式。小叶神经元以及R7和R8感光细胞形成突触,与将视觉信息引导出髓质进入小叶球和小叶板的神经元连接。通过信息穿过小叶、髓质、小叶球和小叶板,信息被计算,并允许对环境进行视觉感知。
总的来说,脊椎动物和无脊椎动物的视觉系统之间存在主要相似之处。其中最重要的是分层和径向柱的总体结构。脊椎动物视觉系统中的感光细胞称为杆状体和锥状体。杆状体负责光觉和运动。它们的功能与无脊椎动物视觉系统中的R1 - R6感光细胞相同。锥状体是色觉所必需的。这个作用对应于R7和R8感光细胞。
一个主要区别是脊椎动物视网膜中存在突触。如前所述,果蝇的视网膜中没有突触。所有感光细胞的突触连接都位于层板(R1 – R6)或髓质(R7 – R8)。脊椎动物的视觉系统在视网膜中也显示出不同的细胞类型。它不仅包含感光细胞,还包含水平细胞、双极细胞、无长突细胞和神经节细胞。这导致了细胞类型之间巨大的连接性,并导致了五个不同层的形成,这些层可以通过它们是否包含细胞体或突触来区分。在果蝇视觉系统的视网膜中无法观察到水平层的形成。在脊椎动物中,大部分视觉计算发生在视网膜中,而无脊椎动物的视觉输入计算则在视网膜、层板和髓质之间分配。
昆虫视觉系统的发展以 R7 和 R8 感光细胞的逐步靶向为例。所有感光细胞在层板(R1 – R6)或髓质(R7 和 R8)中以高度特异性的方式靶向。本文描述了 R7 和 R8 靶向过程中的具体步骤。R7 靶向髓质层 M6,而 R8 最终靶向髓质层 M3。在幼虫龄期,发育中的复眼的起点被称为眼盘。视网膜中的感光细胞开始分化,但层板和髓质在幼虫龄期的开始时没有被轴突支配。在整个幼虫龄期,感光细胞从后端到前端开始分化。第一个分化的感光细胞是 R8。R8 诱导剩余的感光细胞以特定的顺序分化。R8 的轴突构成先锋轴突,因此来自同一小眼的 R1 – R7 的轴突可以定向以到达层板。R1 – R6 进行突触发生以连接层板神经元。特定的靶向是神经叠加原理的基础,如前所述。通过向层板生长,轴突在眼睛和大脑之间建立连接。感光细胞之间的相对位置在生长过程中保持不变,以确保对环境的正确感知。因此,拓扑结构得以保持。R7 和 R8 继续生长直到它们到达髓质。R8 感光细胞在发育中的髓质的顶端表面暂停,被称为 R8 暂时层。跟随 R8 先锋轴突的 R7 感光细胞继续生长,直到它们到达位于 R8 暂时层基部的 R7 暂时层。层板神经元随后延伸轴突朝髓质生长。当它们到达髓质时,它们开始径向和水平分支。它们在 R8 暂时层和 R7 暂时层之间建立不同的层,从而增加它们之间的距离。只有在所有层板神经元支配髓质后,R7 和 R8 才开始再次生长。它们一直延伸到最终的目标层,并发出称为丝状伪足的细突起。在它们最终的目标层中,R7 和 R8 进行突触发生。许多不同的分子线索参与靶向步骤和一个特定髓质层的特异性靶向,但它们尚未完全了解。
S. Hakeda-Suzuki,T. Suzuki (2014) 细胞表面控制果蝇视觉系统中层特异性靶向。基因遗传系统 89: 9-15 J. Sanes,S. Zipursky (2010) 昆虫和脊椎动物视觉系统的设计原则。神经元 66: 15-36
招潮蟹是一种非常适合研究其视觉系统以及该系统如何适应其生活环境和行为特征的物种。它们不会远离自己的洞穴,通常生活在 1 m2 的范围内[1]。它们的眼柄赋予了它们全景视野,因此它们不需要调整方向就能看到显著物体[2]。此外,它们的栖息地主要是视觉结构简单的开阔泥滩[3][4]。这些因素使得在自然条件下监测螃蟹的行为以及它们所暴露的视觉信息成为可能,从而可以对它们神经系统中进行的视觉处理进行详细分析[1]。最后,招潮蟹视觉的分辨率有限,因此可以通过简单的视觉模型来操纵它们的行为,这些模型被误认为是捕食鸟类或其他螃蟹[1]。研究招潮蟹视觉系统的这些方面清楚地表明,它们的视觉并没有进化到忠实地传递所有图像信息,而是只检测与它们生存相关的事件,包括捕食者的存在或潜在的配偶[1]。

招潮蟹的视觉系统与其行为模式和生活环境之间存在着密切的联系。尽管招潮蟹的视觉敏锐度可能有限,但这反映了大多数物种的穴居特性,它们不需要进行长距离导航,因此没有被发现是依靠视觉地标进行引导的[5][6][7]。有些种类的招潮蟹会进行长距离的觅食或交配,这些螃蟹被发现会利用远距离地标的全景图像和偏振阳光的模式来定向[1]。对于招潮蟹的大多数行为来说,视觉环境充当一个不断变化的背景,需要将其过滤掉,以便能够检测到显著的事件[1]。招潮蟹视觉系统的一些关键特征是:它们的的眼睛位于竖立的眼柄的末端,赋予它们全景视野;并且这些眼睛具有复眼结构,可以非均匀地分布感光细胞。
招潮蟹的眼睛位于垂直的眼柄顶端,这使它们拥有更大的视野,因为身体遮挡的场景更少。眼睛抬高也使招潮蟹能够利用地平线作为区分捕食者(在地平线上方飞行的鸟类)和其他在 地平线下方螃蟹的界线[8][9]。不同种类的螃蟹具有不同的眼柄排列方式,这取决于它们生存环境的结构。生活在平坦环境中的螃蟹拥有更加靠近、更高的眼柄。这种靠近的空间限制了立体深度估计,但在平坦的环境中,物体在地面上的位置可以在视觉区域中用作更可靠的距离指示器,因为更近的物体看起来更低[1]。相反,生活在不太平坦的环境(如岩石海岸或茂密的红树林)中的螃蟹拥有更加远离、更短的眼柄[10][11]。螃蟹的眼柄长度和间距之间存在一种权衡,因为它们的身体正面有水平的凹槽,可以将眼睛降低到其中以保护眼睛[1]。以下图像展示了具有不同眼柄长度的螃蟹的示例。
- 蟹眼柄变化
-
招潮蟹 Gelasimus vomeris, 拥有靠近的、高眼柄。
-
招潮蟹 Uca pugilator,拥有中等间距、中等高度的眼柄。
-
紫石蟹, Leptograpsus variegatus, 拥有远离的、短眼柄。
复眼和感光细胞的分布
[edit | edit source]除了眼睛的位置外,招潮蟹眼睛内部的感光细胞结构和排列方式也经过进化以适应其环境。它们拥有复眼,由数百或数千个独立的感光结构(称为小眼)组成,每个小眼都有自己的角膜、晶状体和感光细胞。与单眼相比,复眼的解析度有限,但能够在视觉区域内改变感受器密度,因此招潮蟹获得的视觉信息可以针对其行为进行优化[12]。特别是,招潮蟹在垂直方向上的解析度远远高于水平方向,这得益于非常椭圆形,几乎是圆柱形的眼睛,具有更大的垂直半径[1]。这使得沿着地面平面能够解析出更多细节,由于螃蟹的视野非常靠近地面,因此地面平面在螃蟹的视觉区域中有一些压缩。此外,小眼的分布严重偏向于地平线:尽管螃蟹的视觉区域覆盖了大约 72% 的垂直轴,但 30% 的小眼朝向地平线 ±9° 以内,50% 的小眼朝向地平线 ±18° 以内[12]。最近的成像技术表明,招潮蟹的眼睛中实际上存在两条不同的高解析度视觉条纹,一条就在地平线之上,另一条就在地平线之下。捕食性鸟类比招潮蟹更大,并从上方飞过[13],因此从螃蟹的视角来看,它们几乎完全出现在地平线之上[1]。而且,因为招潮蟹的眼睛位于垂直眼柄的顶部,所以它们总是看到其他螃蟹的身体在地平线之下[8]。因此,人们推测地平线以上的高解析度条纹用于检测捕食者,而地平线以下的条纹用于识别同类[12]。远离地平线的小眼稀疏分布表明,螃蟹并没有试图重建视觉世界中这些部位的详细图像,而是快速检测潜在的威胁并做出相应的反应。事实上,在招潮蟹躲避捕食性鸟类的距离处,这些鸟类只占据少数个别小眼的视野[1]。
辨色能力
[edit | edit source]招潮蟹是否具有辨色能力,这一直是一个争论不休的问题。由于单个小眼之间存在屏蔽色素“遮光板”以防止杂散光在小眼之间反射,导致测量结果失真,因此很难通过实验进行分析[1]。每个小眼都有八个感光受体,即 R1-R8,前七个受体明显大于第八个受体。对前七个受体的测量结果显示,它们之间的光谱敏感度一致,峰值在 508 纳米到 530 纳米之间[14]。然而,行为学研究表明,一些招潮蟹物种可以区分不同颜色的刺激[15]。最近对招潮蟹视觉的分子分析确定,三个基因负责编码它们的辨色视蛋白色素。R1-R7 包含两种中波长敏感色素中的一个或两个,而第三种短波长敏感色素仅在 R8 中发现[16],为招潮蟹可能具有辨色能力提供了证据。

塑造招潮蟹视觉系统并受到视觉系统塑造的招潮蟹行为的例子
[edit | edit source]洞穴防御行为
[edit | edit source]招潮蟹的洞穴有许多功能。它可以保护螃蟹免受捕食者的侵害,提供食物和水,并将螃蟹置于其他螃蟹(包括潜在的配偶和竞争者)的邻近区域[1]。但由于招潮蟹身材矮小,并且生活在平坦的环境中,因此洞穴入口在很短的距离内就会变得不可见[18]。因此,招潮蟹在四处游荡时会监控自己的活动,通过一个称为路径整合的过程跟踪自己的活动,以便在任何时候都大致了解回到洞穴的方向和距离[5][6][7]。此外,招潮蟹会持续将身体的一侧对准洞穴,以便在捕食者接近或竞争对手试图占据其洞穴时能够快速返回洞穴[1]。
这种洞穴防御行为特别有趣,因为它不会习惯于被假人触发[19],而且因为螃蟹的反应是基于对手距离洞穴的距离,而不是对手距离螃蟹本身的距离。也就是说,这些螃蟹似乎将它们路径整合系统的信息与视觉信息结合起来,以在空间中心参考系中计算出对手螃蟹的位置[1]。这种计算的可能实现方式可以利用这样一个事实:在一个平坦的世界中,螃蟹眼睛中的每个感受器对应于空间中的一个特定位置。此外,螃蟹会保持侧向与洞穴对齐,以便眼睛的同一区域始终监控该区域是否有对手螃蟹。因此,可以仅通过考虑被对手螃蟹刺激的复眼,并根据路径整合给出的螃蟹当前距洞穴的距离进行调节,来计算洞穴和入侵螃蟹之间的距离[20][1]。招潮蟹似乎确实像利用这种基于简单视觉过滤器的计算方法来进行反应一样,当入侵者过于靠近时,它们会冲回洞穴。但是,尚未收集到确切的神经生理学证据。请参阅 Zeil, 2006 中的图 10,以获取清晰的可视化[1]。
捕食者回避和逃跑
[edit | edit source]另一种与招潮蟹视觉系统密切相关的行为是逃跑以避免捕食者。与洞穴防御不同,招潮蟹以自我为中心的的方式对接近的捕食者做出反应,当捕食者过于靠近时会逃到洞穴中[1]。这种行为也受到螃蟹路径整合系统的一些调节,螃蟹在距离洞穴更远时会更早逃跑[19]。然而,它们的反应并不始终如一地反映捕食者的迫在眉睫的危险,因为正如之前提到的,它们通常会在捕食者的图像落在少数几个复眼上时就开始逃跑。在这个范围内,螃蟹无法准确地辨别接近的捕食者的尺寸、方向或速度。但是,巨大的捕食压力迫使螃蟹保持谨慎并逃跑[1]。这会导致一些违反直觉的反应,例如,螃蟹从远处经过的鸟类逃跑的速度比直接接近的鸟类更快,因为前者的视网膜速度更高[21]。
如前所述,招潮蟹生活的开放环境以及它们活动范围内的有限距离使得记录它们的行动以及导致这些行动的视觉刺激成为可能[1]。详细分析接近的鸟类的摄像机镜头(包括捕食性和非捕食性鸟类),以及招潮蟹对这些鸟类的反应,已经提供了关于触发逃跑的视觉信息的更具体知识。特别是,最能解释螃蟹对捕食者反应的视觉特征是视觉闪烁——螃蟹视觉区域中特定位置的局部视觉对比度随时间的变化率[22]。地平线之上复眼的分布非常稀疏[1],因此,像接近的鸟类这样的远距离物体很少会被多个复眼看到,这使得尺寸或运动线索相对不可靠[22]。
行为习惯化
[edit | edit source]与招潮蟹的洞穴防御行为不同(即使经过多次假人展示也不会习惯化)[19],招潮蟹在遇到虚假警报时会习惯化它们的捕食者回避行为:最值得注意的是,在经过一段时间的接触后,它们会对人类实验者的存在变得无动于衷[1]。这种习惯化的神经机制一直是详细分析的主题。钙成像技术被应用于另一种蟹种(Neohelice granulata),结果表明,螃蟹眼睛中的小叶巨型(LG)神经元(位于视网膜和中脑之间)的反应在高频假人刺激展示后被抑制[23]。这一结果与螃蟹行为的变化相一致,即它们不再对视觉运动做出反应,但只持续很短的时间。此外,这种习惯化只会影响刺激应用的视网膜区域[23]。
此外,研究表明,暴露于不同捕食压力的同一蟹种的两个不同种群对假人捕食者刺激的反应不同,并且特定的神经活动表明了这种行为差异[24]。高风险种群的螃蟹对视觉危险刺激反应更强烈,LG 神经元的活动水平更高。低风险种群的螃蟹表现出更低的 LG 神经元活动水平和对相同刺激的行为反应。相反,对全景视觉运动和疼痛刺激的反应在各个种群中是相似的,这表明 LG 神经元与捕食者回避行为及其习惯化密切相关[24][25]。
参考文献
[edit | edit source]- ↑ a b c d e f g h i j k l m n o p q r s t u v Zeil, Jochen; Hemmi, Jan M. (2006-01). "The visual ecology of fiddler crabs". Journal of Comparative Physiology A. 192 (1): 1–25. doi:10.1007/s00359-005-0048-7. ISSN 1432-1351 0340-7594, 1432-1351. Retrieved 2020-05-20.
{{cite journal}}: Check|issn=value (help); Check date values in:|date=(help) - ↑ Land, Michael; Layne, John (1995-07-01). "The visual control of behaviour in fiddler crabs". Journal of Comparative Physiology A. 177 (1): 91–103. doi:10.1007/BF00243401. ISSN 1432-1351. Retrieved 2021-08-20.
- ↑ Land, Michael; Layne, John (1995-07-01). "招潮蟹行为的视觉控制". 比较生理学杂志 A. 177 (1): 81–90. doi:10.1007/BF00243400. ISSN 1432-1351. 检索于 2021-08-20.
- ↑ Zeil, J; Al-Mutairi, M (1996-07-01). "招潮蟹 Uca lactea annulipes 复眼的解析度和小眼尺寸变化". 实验生物学杂志. 199 (7): 1569–1577. doi:10.1242/jeb.199.7.1569. ISSN 0022-0949. 检索于 2021-08-20.
- ↑ a b Zeil, Jochen (1998-09-21). "招潮蟹 (Uca lactea annulipes 和 Uca vomeris: 弓蟹科) 的归巢". 比较生理学杂志 A:感觉、神经和行为生理学. 183 (3): 367–377. doi:10.1007/s003590050263. ISSN 1432-1351 0340-7594, 1432-1351. 检索于 2021-08-21.
{{cite journal}}: 检查|issn=值 (帮助) - ↑ a b Layne, John E.; Barnes, W. Jon P.; Duncan, Lindsey M. J. (2003-12-15). "招潮蟹 Uca rapax 归巢机制 1. 小范围导航系统的空间和时间特征". 实验生物学杂志. 206 (24): 4413–4423. doi:10.1242/jeb.00660. ISSN 0022-0949. 检索于 2021-08-21.
- ↑ a b Layne, John E.; Barnes, W. Jon P.; Duncan, Lindsey M. J. (2003-12-15). "招潮蟹 Uca rapax 归巢机制 2. 路径整合系统的資訊来源和参考系". 实验生物学杂志. 206 (24): 4425–4442. doi:10.1242/jeb.00661. ISSN 0022-0949. 检索于 2021-08-21.
- ↑ a b Layne, John; Land, Michael; Zeil, Jochen (1997-02). "招潮蟹利用视觉地平线来区分捕食者和同类: 证据回顾". 英国海洋生物协会杂志. 77 (1): 43–54. doi:10.1017/S0025315400033774. ISSN 0025-3154 1469-7769, 0025-3154. 检索于 2021-08-21.
{{cite journal}}: 检查|issn=值 (帮助); 检查|date=中的日期值 (帮助) - ↑ Layne, J. E. (1998-08). "视网膜位置是招潮蟹 (Uca pugilator) 识别捕食者的关键". 实验生物学杂志. 201 (Pt 15): 2253–2261. ISSN 0022-0949. PMID 9662496.
{{cite journal}}: 检查|date=中的日期值 (帮助) - ↑ Zeil, J.; Nalbach, G.; Nalbach, H. -O. (1986). "眼睛、眼柄和半陆生蟹的视觉世界". 比较生理学杂志 A. 159 (6): 801–811. doi:10.1007/BF00603733. ISSN 1432-1351 0340-7594, 1432-1351. 检索于 2021-08-21.
{{cite journal}}: 检查|issn=值 (帮助) - ↑ Zeil, Jochen; Nalbach, Gerbera; Nalbach, Hans-Ortwin (1989). "扁平世界中的空间视觉:节肢动物的视光和神经适应". 感觉系统神经生物学. 波士顿,马萨诸塞州:施普林格美国。pp. 123–137. ISBN 978-1-4899-2519-0. 检索于 2021-08-21.
{{cite book}}: 未知参数|chapterurl=被忽略 (|chapter-url=建议) (帮助); 未知参数|editors=被忽略 (|editor=建议) (帮助) - ↑ a b c Bagheri, Zahra M.; Jessop, Anna-Lee; Kato, Susumu; Partridge, Julian C.; Shaw, Jeremy; Ogawa, Yuri; Hemmi, Jan M. (2019-01-01). "一种用于绘制复眼空间分辨率的新方法表明招潮蟹有两个视觉条纹". 实验生物学杂志: –210195. doi:10.1242/jeb.210195. ISSN 0022-0949 1477-9145, 0022-0949. 检索于 2021-08-18.
{{cite journal}}: 检查|issn=值 (帮助) - ↑ Land, M. F. (1999-04-15). "头部运动在燕鸥(鸟纲,鸥科)的搜索和捕获策略中的作用". 比较生理学杂志 A:感觉、神经和行为生理学. 184 (3): 265–272. doi:10.1007/s003590050324. ISSN 1432-1351 0340-7594, 1432-1351. 检索于 2021-08-21.
{{cite journal}}: 检查|issn=值 (帮助) - ↑ Jordão, Joana M.; Cronin, Thomas W.; Oliveira, Rui F. (2007-02-01). "通过 *原位* 显微分光光度法测量的四种招潮蟹(Uca pugnax、Uca pugilator、Uca vomeris 和 Uca tangeri)的光谱敏感性". 实验生物学杂志. 210 (3): 447–453. doi:10.1242/jeb.02658. ISSN 0022-0949 1477-9145, 0022-0949. 检索于 2021-08-18.
{{cite journal}}: 检查|issn=值 (帮助) - ↑ Detto, Tanya; Backwell, Patricia R.Y; Hemmi, Jan M; Zeil, Jochen (2006-07-07). "招潮蟹(Uca mjoebergi 和 Uca capricornis)的视觉介导物种和邻居识别". 英国皇家学会会刊 B:生物科学. 273 (1594): 1661–1666. doi:10.1098/rspb.2006.3503. ISSN 0962-8452. PMC 1634930. PMID 16769638. 检索于 2021-08-21.
{{cite journal}}: CS1 维护:PMC 格式 (链接) - ↑ Rajkumar, Premraj; Rollmann, Stephanie M.; Cook, Tiffany A.; Layne, John E. (2010-12-15). "大西洋沙招潮蟹(Uca pugilator)的颜色辨别分子证据". 实验生物学杂志. 213 (24): 4240–4248. doi:10.1242/jeb.051011. ISSN 0022-0949 1477-9145, 0022-0949. 检索于 2021-08-18.
{{cite journal}}: 检查|issn=值 (帮助) - ↑ Spitzner, Franziska; Meth, Rebecca; Krüger, Christina; Nischik, Emanuel; Eiler, Stefan; Sombke, Andy; Torres, Gabriela; Harzsch, Steffen (2018-12). "欧洲滨蟹幼虫器官发生的图谱 (十足目, 短尾下目, 梭子蟹科)". 动物学前沿. 15 (1): 27. doi:10.1186/s12983-018-0271-z. ISSN 1742-9994. 检索于 2021-08-22.
{{cite journal}}: 检查日期值:|date=(帮助) - ↑ Zeil, Jochen; Layne, John (2002). "招潮蟹的路径整合及其与栖息地和社会生活的关系". 在 Konrad Wiese (编). 神经生物学中的甲壳动物实验系统. 柏林, 海德堡: 施普林格. pp. 227–246. doi:10.1007/978-3-642-56092-7_13. ISBN 978-3-642-56092-7.
- ↑ a b c Hemmi, Jan M. (2005-03). "招潮蟹的捕食者回避:1. 逃避决策与捕食风险的关系". 动物行为. 69 (3): 603–614. doi:10.1016/j.anbehav.2004.06.018. ISSN 0003-3472. 检索于 2021-08-21.
{{cite journal}}: 检查日期值:|date=(帮助) - ↑ Hemmi, Jan M.; Zeil, Jochen (2003-01). "节肢动物对物体间距离的稳健判断". 自然. 421 (6919): 160–163. doi:10.1038/nature01247. ISSN 1476-4687. 检索于 2021-08-21.
{{cite journal}}: 检查日期值:|date=(帮助) - ↑ Hemmi, Jan M. (2005-03). "招潮蟹的捕食者回避:2. 视觉线索". 动物行为. 69 (3): 615–625. doi:10.1016/j.anbehav.2004.06.019. ISSN 0003-3472. 检索于 2021-08-21.
{{cite journal}}: 检查日期值:|date=(帮助) - ↑ a b Smolka, Jochen; Zeil, Jochen; Hemmi, Jan M. (2011-12-07). "引发招潮蟹捕食者回避的自然视觉线索". 英国皇家学会学报B辑:生物科学. 278 (1724): 3584–3592. doi:10.1098/rspb.2010.2746. ISSN 1471-2954 0962-8452, 1471-2954. 检索于 2021-08-18.
{{cite journal}}: 检查|issn=值 (帮助) - ↑ a b Berón de Astrada, Martín; Bengochea, Mercedes; Sztarker, Julieta; Delorenzi, Alejandro; Tomsic, Daniel (2013-08-05). "节肢动物视叶中的行为相关神经可塑性". 当代生物学. 23 (15): 1389–1398. doi:10.1016/j.cub.2013.05.061. ISSN 0960-9822. 检索于 2021-08-18.
- ↑ a b Magani, Fiorella; Luppi, Tomas; Nuñez, Jesus; Tomsic, Daniel (2016-04-15). "捕食风险通过塑造特定脑神经元的反应来改变行为". 实验生物学杂志. 219 (8): 1172–1177. doi:10.1242/jeb.136903. ISSN 0022-0949. 检索于 2021-08-18.
- ↑ Tomsic, Daniel (2016-12). "螃蟹的行为视觉运动处理". 神经生物学最新观点. 41: 113–121. doi:10.1016/j.conb.2016.09.003. ISSN 0959-4388. 检索于 2020-05-20.
{{cite journal}}: 请检查日期值:|date=(帮助)











