结构生物化学/蛋白质/结构
以下是蛋白质一级结构的总结
一级结构
- 它是氨基酸的序列。
- 它是一个线性聚合物:将一个氨基酸的α-羧基与另一个氨基酸的α-氨基连接 => 肽键(共价键)。
- 在一些蛋白质中,线性多肽链是交联的:二硫键。
一级结构是多肽,其中
- 肽中的每个氨基酸都是一个残基
- 有一个规律重复的片段称为主链或骨架,以及一个可变的部分,包含侧链。
蛋白质的一级结构是具有一系列氨基酸的线性聚合物。这些氨基酸通过 C-N 键连接,也称为肽键。肽键的形成产生水分子作为副产物,当一个氨基酸 N 端失去氢而另一个氨基酸 C 端失去 -羟基时。因此,多肽或多肽链,是一个描述众多氨基酸之间多个连接的肽键的术语。多肽链中的每个氨基酸都是一个单元,通常称为残基。这些链具有平面骨架,因为肽键由于肽键形成的羰基碳和氮之间存在共振而具有双键特性。每种蛋白质的一级结构都由特定的基因精确决定。氨基酸链中的 C-N 键具有双键的特征。该键具有短的键长且稳定。它不能旋转。这种双键特征可以用结构来解释,即氨基酸链中的 R 基团避免了空间冲突。
氨基酸通过肽键连接形成多肽链;每个氨基酸单元称为残基;由相同单元构建的多肽链称为主链或骨架,以及一个变化的 R 基团,即侧链。
蛋白质结构主要受疏水效应和极性残基与其他类型键之间的相互作用控制。疏水效应是原始蛋白质结构的主要决定因素。蛋白质内部非极性侧链的聚集受到熵增加的青睐,否则水分子将在疏水基团周围形成笼子。疏水侧链很好地表明了多肽链的哪些部分位于内部,与水性溶剂没有接触。氢键是蛋白质结构的中心特征,但对蛋白质稳定性只有微小的贡献。氢键通过从少量疏水稳定的构象中选择蛋白质的独特结构,微调三级结构。二硫键可以在蛋白质折叠到其天然构象时在多肽链内和之间形成。金属离子也可以起到在蛋白质内部交联的作用。
1) 温度
2) pH
极端温度会导致多肽链展开,从而导致结构发生变化,通常会导致功能丧失。如果蛋白质作为酶发挥作用,变性会导致该蛋白质失去其酶活性。随着包含蛋白质的溶液温度升高,额外的热量会导致键的扭曲和弯曲。当蛋白质开始变性时,蛋白质的二级结构会丢失并采用随机卷曲构象。氨基酸侧链之间的共价相互作用,例如二硫键,也会丢失。
在高或低 pH 水平下,蛋白质会由于质子的丢失或获得而变性,因此会失去电荷或带电,具体取决于 pH 变化的方向和幅度。这将消除维持蛋白质折叠形状所需的许多离子相互作用。结果,结构的变化会导致功能的变化或丧失。
在多肽被纯化后,应确定多肽的组成。为了确定存在哪些氨基酸以及每种氨基酸的含量,整个链通过酰胺水解(6N HCl,1100C,24hr)降解,以产生所有游离氨基酸残基的混合物。通过氨基酸分析仪分离混合物并记录其组成。氨基酸分析仪通过给出色谱图来确定多肽的组成,色谱图记录序列中存在的每种氨基酸的峰值。然而,氨基酸分析仪只能给出多肽的组成,而不能给出氨基酸相互连接的顺序。
为了确定氨基酸序列,通常从确定多肽的氨基末端开始。该过程被称为埃德曼降解,所使用的试剂是苯异硫氰酸酯。

在埃德曼降解中,末端氨基与异硫氰酸酯试剂反应生成硫脲衍生物。用弱酸处理后,标记的氨基酸会转化为苯硫代乙内酰胺,而其余的多肽保持不变。由于所有氨基酸的苯硫代乙内酰胺都是已知的,因此可以很容易地确定原始多肽的氨基末端。但是,埃德曼降解只能用于识别多肽的氨基端;因此,对于由数百个氨基酸组成的多肽来说,它通常不是一种实用的方法。此外,多次降解循环会导致杂质积累,这将严重影响肽的产量。高产率意味着不是完全定量的,并且在每一步降解中,未完全反应的肽会与新肽混合,导致无法处理的混合物。
换句话说,二级结构指的是序列中相邻氨基酸残基的空间排列。α-螺旋和 β-链是二级结构的元素。
蛋白质的二级结构通常在构象上非常规则。它们是一级结构的空间排列。α螺旋和β折叠片是两种类型的规则结构。有趣的是,构成多肽的某些氨基酸实际上会偏好特定的折叠结构。α螺旋似乎是默认结构,但由于立体因素等相互作用,某些氨基酸会更倾向于折叠成β折叠片等等。例如,缬氨酸、异亮氨酸和苏氨酸等氨基酸在β碳上都有支链,这会导致α螺旋排列中的空间冲突。甘氨酸是最小的氨基酸,可以适应所有结构,因此它不特别偏好螺旋形成。因此,这些氨基酸主要出现在它们的侧链可以很好地适应β构型的位置。
多肽主链的结构主要是氢键;每个残基都有一个羰基,它是一个良好的氢键受体;氮-氢基团,一个良好的氢键供体。
α螺旋看起来像结构的外部。+右手出现在拉氏曼达图的右下方
+ Left hand (LOOP): rare on the left top of Ramachandran plot
α螺旋的一般物理性质是


- 每圈3.6个残基
- 平移(上升)1.5埃
- 旋转100度
- 螺距(或高度)5.4埃(1.5埃*3.6个残基)

- 螺旋方向 = 顺时针(通常),因为它会受到更少的空间位阻
- 螺旋内部由盘绕的骨架组成,侧链在螺旋阵列中向外突出
- 第一个羰基与第四个氨基上的氢之间的氢键
- α螺旋的简写图是一个带状图或棒状图


- α螺旋落在拉氏曼达图的象限1(左手螺旋)和3(右手螺旋)内
I. 卷曲螺旋
α卷曲螺旋由两个或多个相互交织的α螺旋组成,形成一个稳定的结构。这种结构为组织和细胞提供支撑,有助于细胞骨架和肌球蛋白和肌动蛋白等肌肉蛋白。α角蛋白由七肽重复序列(7个氨基酸序列的不完美重复)组成。这促进了两个或多个螺旋之间的键合。
II. 胶原蛋白
胶原蛋白是另一种类型的纤维蛋白,由三个螺旋状多肽链组成。它是哺乳动物中最丰富的蛋白质,构成皮肤、骨骼、肌腱、软骨和牙齿的重要组成部分。皱纹也是由这种蛋白质的降解引起的。在胶原蛋白的结构中,多肽链中每三个残基就有一个甘氨酸,因为它是唯一足够小的残基,可以适合超螺旋电缆的内部位置。与正常的α螺旋不同,每个胶原蛋白螺旋都通过脯氨酸和羟脯氨酸残基的吡咯烷环的立体排斥来稳定。但是,三个交织的链通过氢键来稳定。
I. 基序
基序是二级结构的简单组合,例如螺旋-转角-螺旋,它由两个由转角隔开的螺旋组成。螺旋-转角-螺旋基序通常存在于DNA结合蛋白中。
II. 结构域
结构域或紧凑的球状体由多个基序组成。它们是通过转角或环连接的两个或多个紧凑区域折叠的多肽链。它们的结构是球形的,这对蛋白质有利,因为它节省了空间。通常,球状蛋白的内部由疏水性氨基酸组成,例如亮氨酸、缬氨酸、蛋氨酸和苯丙氨酸。外部由具有亲水性趋势的氨基酸组成,例如天冬氨酸、谷氨酸、赖氨酸和精氨酸。球状蛋白的一个例子是肌红蛋白,它是肌肉中的氧气载体。它是一个非常紧凑的分子,仅由α螺旋(70%)组成,除了环和转角(30%)。
研究跨膜和非跨膜螺旋的拓扑结构有助于解答有关膜蛋白插入的许多问题。特别是,研究拓扑结构的序列和脂质依赖性可以提供对翻译后拓扑结构变化的见解。此外,研究拓扑结构已导致设计具有生物医学应用的疏水螺旋。例如,已设计出一种名为pHLIP肽的肿瘤标记物。
不同的测试已被用于显示对疏水螺旋的不同影响。例如,色氨酸和酪氨酸等亲水残基会破坏跨膜状态。亲水结构域不能穿过膜,因此会阻断任何跨膜和非跨膜平衡。此外,带电的离子化残基也会破坏跨膜状态。在螺旋-螺旋相互作用中也实现了跨膜的稳定。此外,阴离子脂质会促进疏水性肽和蛋白质的膜结合。
α螺旋、β链和转角是由氨基酸之间肽 N-H 和 C=O 基团之间的规律氢键模式形成的,这些氨基酸在线性序列中彼此靠近。这种折叠片段被称为二级结构。
α螺旋由一条多肽链组成,其中氨基(N-H)与距离 4 个残基的羧基(C=O)形成氢键。α螺旋是一种棒状结构。链的紧密盘绕的骨架形成棒的内部,侧链在螺旋阵列中向外延伸。这会导致一个顺时针卷曲结构,被称为“右手”螺旋方向。这种折叠模式以及β折叠片实际上是由莱纳斯·鲍林和罗伯特·科里在人们实际看到它之前半个世纪提出的。大多数α链位于拉氏曼达图的左下角或右上角。本质上,大多数α螺旋存在于右手螺旋区域。α螺旋特别适合跨膜蛋白,因为肽骨架的所有氨基氢和羰基氧原子都可以相互作用形成链内氢键,而它的脂肪族侧链可以在细胞膜的疏水环境中稳定。
丙氨酸、亮氨酸和谷氨酸(在生理 pH 值下以谷氨酸形式存在)是α螺旋中最常见的残基。
蛋白质的α螺旋含量范围很广,从无到接近 100%。
一般来说,α螺旋是多肽链的“正常”形状;然而,某些氨基酸的特征会破坏α螺旋形成,反而有利于β链形成。在β碳上具有支链的氨基酸(即缬氨酸、苏氨酸和异亮氨酸)是有问题的,因为它们会拥挤肽骨架。连接到β碳的 H 键受体/供体基团(即丝氨酸、天冬酰胺和天冬氨酸)可以与骨架胺和羧基基团键合,再次干扰α螺旋形成。
虽然单个氨基酸可能偏向于一种形式或另一种形式,但即使是短的(<7 个氨基酸)肽链的二级结构的预测也只有 60-70% 的准确率。这种可变性表明其他因素,例如与链中更远处的氨基酸的三级相互作用,会影响其折叠成观察到的三级结构。
β链是
- 大约 ʊ = 120° 和 ϕ = -120°
- 你有角度,你就能形成之字形
之字形结构中氨基酸之间的距离是 3.5 埃
与α螺旋结构形成对比的是,β折叠是由多条多肽链通过氢键连接形成的片状结构。氢键形成于两条不同链之间的 NH 和 CO 基团之间,而并非在同一条链内,这与α螺旋结构形成的氢键不同。由于其通常呈波纹状或褶皱状外观,这种二级结构构象被称为β折叠片。β链可以以平行、反平行或混合(平行和反平行)方式排列。

反平行构象是最简单的构象。相邻多肽链的 N 端和 C 端彼此相反,这意味着一条肽链的 N 端与相邻链的 C 端对齐。在反平行构象中,每个氨基酸与相邻链中的一个氨基酸线性键合。

平行排列发生在相邻多肽链沿相同方向延伸时,这意味着肽链的 N 端和 C 端对齐。结果,一个氨基酸不能像在反平行构象中那样直接键合到相邻链中互补的氨基酸。相反,来自一条链的氨基与相邻链上的羰基键合。来自初始链的羰基然后与相邻链上两个残基之前的氨基形成氢键。平行构象中氢键的扭曲会影响氢键的强度,因为氢键在平面时最强。因此,由于氢键的这种扭曲,平行β折叠不如反平行β折叠稳定(例如,形成少于 5 个残基的平行β折叠非常罕见)。
β链的侧链交替排列在链的相对两侧。β链中氨基酸之间的距离为 3.5 Å,这比α链中 1.5 Å 的距离更长。因此,β折叠比α螺旋更灵活,可以是扁平的,也可以是略微扭曲的。蛋白质中β折叠的平均长度为 6 个氨基酸残基。实际长度范围从 2 到 22 个残基。

在拉曼图中,β折叠位于左上角象限。这对应于 ψ 角为 0° 到 180°,Φ 角为 -180° 到 0°。

在 3D 模型中,β折叠的视觉表示通常用一个指向链方向的扁平箭头表示。
环状结构很重要,但α螺旋和β链才是蛋白质二级结构的关键。它们与蛋白质的二级结构有关。
多肽链可以通过形成反向转角和环状结构来改变方向。α螺旋和β链通过这些转角和环状结构连接在一起。大多数蛋白质具有紧凑的球状形状,这是由于多肽链方向的逆转,这使得多肽可以折叠回自身。在许多反向转角中,多肽链中残基 i 的 CO 基团与残基 i+3 的 NH 基团形成氢键。转角有助于稳定多肽链中突然的方向变化。环状结构是更复杂的链反转结构,它们是刚性的且定义明确。环状结构和转角通常位于蛋白质的表面,因此它们通常参与蛋白质与其他分子的相互作用。在环状结构中,没有像螺旋或β链中那样的规则结构。
关于转角在蛋白质折叠中的作用,已经提出了两种假设。一种观点认为,转角通过将规则二级结构元件之间的相互作用聚集在一起,在折叠中起着至关重要的作用。这种观点得到了诱变研究的支持,这些研究表明特定残基在某些蛋白质的转角中起着至关重要的作用。此外,转角中 X-脯氨酸肽键的非天然异构体可以完全阻断某些蛋白质的构象折叠。在相反的观点中,转角在折叠中起着被动作用。这种观点得到了大多数转角中观察到的氨基酸保守性差的支持。此外,转角中许多 X-脯氨酸肽键的非天然异构体对折叠几乎没有或根本没有影响。
当二级结构元件以特定的几何排列组合时,就形成了一个基序。β发夹转角是一种排列方式;它们是最简单的结构之一,存在于球状蛋白质中。在转弯后,反平行链可以通过羰基碳与肽主链氮之间的氢键有效地结合。研究表明,70% 的 β 发夹长度小于 7 个残基;大多数长度为 2 个残基。有两种类型的双残基 β 发夹转角。第一种,I 型,形成左手 α 螺旋构象。这种左手构象由于上述氨基酸的性质,具有正的 φ 角。甘氨酸没有侧链来立体干扰转折的氨基酸序列。天冬酰胺和天冬氨酸都能很容易地与羰基氧形成氢键,作为氢键受体。I 型转角中的第二个氨基酸通常是甘氨酸,因为使用任何具有侧链的氨基酸都会导致空间位阻。在 II 型 β 发夹转角中,第一个残基只能是甘氨酸,因为存在空间位阻。然而,第二个残基通常是极性的,例如丝氨酸或苏氨酸。
纤维状蛋白质,如 α-角蛋白和胶原蛋白,由两个右手 α 螺旋相互缠绕形成一种称为 α 卷曲螺旋的左手超螺旋。这种蛋白质中的两个螺旋通常通过弱相互作用(如范德华力力和离子相互作用)相互交联。侧链相互作用可以每隔七个残基重复一次,形成七肽重复序列。另一种形式的纤维状蛋白质,胶原蛋白,存在于三个螺旋状多肽链中。这些链相对较长,约 1000 个残基,由于拥挤,每三个残基出现一次甘氨酸。虽然螺旋通过空间斥力稳定,但三条链通过氢键稳定。这些蛋白质通常在生物体中起结构作用,α-角蛋白通常存在于细胞的细胞骨架中,以及某些肌肉蛋白中。胶原蛋白通常存在于牙齿、皮肤和肌腱中。
预测多肽链将构象成哪个二级结构组(α-螺旋、β-折叠片/链或转角/环状结构)的科学并不特别精确。然而,某些氨基酸的二级结构形成频率在实际科学实验中已被记录,这些值可以使科学家根据蛋白质的氨基酸组成预测蛋白质的折叠,准确率约为 60-70%。六个或更少残基的片段通常可以用这种准确率预测。尽管某些氨基酸倾向于折叠成其优选的构象,但当然也存在例外,因此二级结构预测并不总是准确的。三级相互作用,即与彼此相距更远的残基之间的相互作用,也可以决定折叠结构。每个氨基酸都对二级结构有一种偏好,但通常它对一种结构的偏好只是略微大于另一种结构,因此,不幸的是,这并不意味着什么。氨基酸可以在一种蛋白质中出现在α螺旋中,而在另一种蛋白质中出现在β折叠片中。由于基于氨基酸序列的二级结构的不可预测性,二级结构正在与相似家族的序列进行比较和预测。
在二级结构预测研究中,历史上出现了各种技术。借助计算机,预测一直是生物信息学中一个被追求的研究课题,并且许多方法仍在不断提出。在莱纳斯·鲍林和罗伯特·科里于 1951 年发现蛋白质中的周期性 α 螺旋和 β 折叠片结构之后,蛋白质结构预测的进一步阐明开始发展。二级结构预测中的一种主要方法是Chou-Fasman 方法;它的准确率为 50-60%。这种方法基于为特定氨基酸残基分配一组预测值,然后对该值应用算法。此后不久,对该方法进行了进一步改进,即GOR 方法,它是在 20 世纪 70 年代后期开发的,并利用了信息论|熵和信息概念来进行二级结构预测。当该方法被设计出来时,其准确率约为 65%,但是,也对该方法进行了改进。存在一些演绎技术,其中在已识别蛋白质中找到相似序列。这种方法是通过让计算机软件搜索已识别蛋白质的数据库来实现的。与之相反的是从头算方法,该方法在不查看相似残基序列的情况下构建三维模型。这种方法基于氢键原理和定位。
折叠预测的其他方法和因素包括分析氨基酸侧链的基本化学趋势,以确定其在二级结构中的偏好。α-螺旋被认为是默认结构,因此破坏α-螺旋的氨基酸通常存在于β折叠片或环状结构和转角中。例如,缬氨酸、苏氨酸和异亮氨酸由于 β 碳的支化,通常会破坏螺旋。这三个氨基酸残基更常见于β折叠片中,它们的侧链会位于与主链不同的平面上。还有一些氨基酸残基既不偏好α-螺旋也不偏好β折叠片,例如,脯氨酸的 φ 角受限于约 60° 度,并且没有 NH 基团,所有这些都是由于它是有环的。这会破坏α-螺旋和β折叠片,因此它主要存在于环状结构和转角中。一个反直观的例子是甘氨酸,根据其较小的尺寸,理论上它可以很容易地适应任何结构,但实际上它也倾向于避免α-螺旋和β折叠片。折叠也肯定依赖于侧链之间的化学相互作用,因此周围的氨基相互作用也会影响折叠趋势。这些趋势反映在单个氨基酸的二级结构频率中。
以下是特定氨基酸二级结构的相对倾向
α-螺旋:Glu、Ala、Leu、Met、Lys、Arg、Gln、His
β-折叠:Val、Ile、Tyr、Cys、Trp、Phe、Thr
转角和环:Gly、Asn、Asp、Pro、Ser
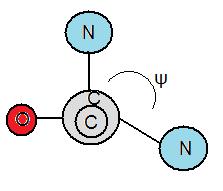
扭转角
[edit | edit source]扭转角也称为二面角。扭转角是原子之间键的度数测量。蛋白质的折叠受氨基键旋转度的影响。多肽键中存在两种不同类型的扭转角。Phi, φ 是肽键的 α-碳原子和氮原子之间的角度。另一个键称为psi, ψ,它是 α-碳原子和羰基之间的角度。为了测量 φ,必须从氮原子朝向 α-碳原子看,以测量角度是负的还是正的。如果 α-碳原子逆时针旋转,则角度为负,反之亦然。此外,为了测量 ψ,必须从氮原子朝向羰基看。同样,如果羰基逆时针旋转,则角度为负,反之亦然。
Ramachandran 图
[edit | edit source]由 Gopalasamudram Ramachandran 创建的Ramachandran 图有助于确定氨基酸是否会形成 α-螺旋、β-折叠、环或转角。Ramachandran 图被分为四个象限,以角度 ϕ 为 x 轴,以角度 ψ 为 y 轴。扭转角的组合会将氨基酸置于特定象限中,从而确定它是否会形成 α-螺旋、β-折叠、环或转角。那些在象限 1 和 3 中连续出现几次的氨基酸会形成 α-螺旋,而那些在象限 2 中重复出现的氨基酸会形成 β-折叠。象限 4 通常是不利的,因为存在空间位阻。此外,它在大多数情况下是不可能的,因为象限 4 中的扭转角组合无法存在,因为它们会导致氨基酸原子之间发生碰撞。如果氨基酸落在不同的象限中,并且没有重复,那么它们就会成为环或转角。此外,空间排斥原理指出,两个原子不能同时占据同一个位置。
肌红蛋白是三级结构的一个例子。肌红蛋白是一个极其紧凑的分子。它是肌肉中的一种氧气载体,是一个包含 153 个氨基酸的单一多肽链。肌红蛋白结合氧气的能力取决于血红素的存在,血红素是一个非多肽辅基,由原卟啉 IX 和一个中心铁原子组成。
三级结构
[edit | edit source]蛋白质的三级结构是蛋白质的三维结构。这种三维结构主要由氨基酸序列决定,氨基酸序列由蛋白质的一级结构表示,但氨基酸序列不能完全预测三维结构的形成方式。影响三级结构最终形状的另一个因素是蛋白质合成所处的环境。三级结构由蛋白质骨架中疏水氨基酸残基的序列稳定。内部由疏水侧链组成,而表面由与水性环境相互作用的亲水氨基酸组成。
三级结构是由各种氨基酸侧链之间的相互作用形成的,特别是两个半胱氨酸基团之间形成的二硫键。在这个阶段,一些蛋白质已经完成,而另一些蛋白质则结合了多个多肽亚基,从而形成了四级结构。
成核-凝聚模型。三级折叠过程非常有条理,有关键的中间体。当蛋白质开始折叠时,蛋白质的局部区域首先开始折叠。然后,各个局部折叠结合在一起完成三级结构。关键的概念是,当达到正确的折叠时,这种折叠会保留下来,直到蛋白质的所有其他部分也正确折叠。这种折叠过程遵循推理,因为随机的试错折叠过程不仅需要更长的时间才能完成,而且还需要更多的输入能量。
三级结构是指序列中相距很远的氨基酸残基的空间排列,以及二硫键的模式。三级结构也是最重要的蛋白质结构,用于确定蛋白质的酶活性。
结构
[edit | edit source]

半胱氨酸是一种含有硫醇基的氨基酸,它负责将三级结构连接在一起的二硫键。在三级结构中,当两个螺旋结合在一起时,它们可能通过这些二硫键连接。含有较少二硫键的三级结构会形成更不刚性的结构,这些结构是灵活的,但仍然牢固,并且可以抵抗断裂,例如头发和羊毛。而含有更多由半胱氨酸残基形成的交联二硫键的三级结构会导致更强、更硬、更坚固的结构,例如外骨骼。包含更多二硫键的蛋白质的其他例子包括爪子、指甲和角。
在生物体中可以找到由两个 α-螺旋(如角蛋白)构成的结构。免疫球蛋白,也称为抗体,是全 β-折叠蛋白结构的一个例子。它由大约 7 个反平行 β-折叠组成,排列成 2 个 β-折叠。例如,如果将半胱氨酸突变为另一个氨基酸,它可以编码为不同的蛋白质,从而导致错误折叠。
域
[edit | edit source]一些多肽链折叠成几个紧凑的区域。多肽链中的这些区域称为域,通常范围为 30 到 400 个氨基酸。平均而言,域包含大约 100 个氨基酸。每个域形成自己的三级结构,这有助于蛋白质的整体三级结构。这些域是独立稳定的。稳定是由金属离子或二硫键引起的,这些离子或二硫键导致多肽链折叠。不同的蛋白质可能具有相同的域,即使它们的整体三级结构不同。
有四种类型的域
- 全 α 域 - 纯粹由 α-螺旋组成的域。
- 全 β 域 - 纯粹由 β-折叠组成的域。
- α+β 域 - 由 α-螺旋和 β-折叠组成的域。
- α/β 域 - 由 α-螺旋和 β-折叠组成的域,以 β,α,β 的方式层叠,一个 α-螺旋夹在 2 个 β-折叠之间。
突变
[edit | edit source]为了使蛋白质发挥功能(除了食物中的蛋白质之外),它必须具有完整的三级结构。如果蛋白质的三级结构被破坏,则称其为变性。一旦蛋白质变性,它将无法执行其预定的或原始功能。三级结构改变的主要原因是编码蛋白质的基因发生突变。基因中的突变会导致多米诺骨牌效应,最终导致三级结构降解。降解会导致多种疾病,其中一种称为囊性纤维化。囊性纤维化是由基因突变引起的,该基因称为囊性纤维化跨膜传导调节因子 (CFTR)。这种疾病会导致外分泌腺过度分泌粘液。最常见的是,囊性纤维化患者在 20-30 岁之前就会因肺功能衰竭而死亡。 尿崩症、家族性高胆固醇血症和成骨不全症也是由蛋白质降解引起的疾病。三级结构本身的突变,而不是核苷酸序列的突变,也会导致疾病。这种突变的蛋白质也会聚集并成为不溶性沉积物,称为淀粉样蛋白,从而失去功能。常见的一种突变是疏水 R 基团在疏水环境中折叠到内部,而不是外部。遗传性阿尔茨海默病是一种由三级结构突变引起的疾病。另一种疾病包括疯牛病,它是由 α-螺旋(可溶)突变为 β-折叠(不溶并引起淀粉样蛋白沉积)引起的。 [1]
折叠
[edit | edit source]蛋白质的折叠取决于一级结构中确定的氨基酸序列。它也取决于折叠发生的环境。在疏水环境中,蛋白质的氨基酸的疏水侧链会向外折叠,而亲水侧链会向内折叠,反之亦然,对于亲水环境来说。在一个疏水环境中折叠的蛋白质的一个例子是孔蛋白。它的亲水侧链折叠在内部,从而为水创造了一个通道。具有非极性/疏水侧链的氨基酸,如亮氨酸、缬氨酸、甲硫氨酸、苯丙氨酸和异亮氨酸,会在疏水环境中折叠蛋白质时向外折叠。同样,在亲水环境中,具有极性侧链的氨基酸,如谷氨酰胺和天冬酰胺,会向外折叠,而疏水侧链会向内折叠。
蛋白质的三级结构通过X射线晶体学和核磁共振(NMR)光谱学来确定。X射线晶体学是第一个用于确定蛋白质结构的方法。X射线晶体学是最好的方法之一,因为X射线的波长与蛋白质中发现的共价键的波长相似,从而可以更清晰地可视化分子的结构。分析电子对X射线的散射来确定蛋白质的结构。为了使用X射线晶体学,所讨论的蛋白质必须以晶体形式存在。一些蛋白质容易结晶,而另一些则不然。对于那些不容易结晶的蛋白质,必须使用核磁共振(NMR)光谱学来确定其结构。核磁共振光谱学利用具有磁偶极子和化学位移的原子核的自旋来确定分子的相对位置。
血红蛋白是四级结构的一个例子。血红蛋白是血液中的一种携氧蛋白,由两种类型(分别称为α和β)的两个亚基组成。

四级结构指的是通过分子间相互作用结合在一起的两个或多个多肽链,形成一个多亚基复合物。将这些折叠的蛋白质分子结合在一起的相互作用包括二硫键、氢键、氢键相互作用、疏水相互作用相互作用和伦敦力。这些力通常由肽的侧链传递。
这些多肽链是蛋白质的亚基,能够参与多种功能,例如作为酶催化剂,在细胞的细胞骨架中提供结构支持,甚至构成我们头上的头发。
蛋白质的肽可以相同也可以不同。胰岛素是包含两个相同肽的二聚体,而血红蛋白是包含两个相同α亚基和两个相同β亚基的四聚体。
在命名四级结构时,使用亚基(三级结构)的数量和后缀-mer(希腊语表示“部分,亚基”)
模式继续使用pent-、hex-、hept-、oct-等。

- 胰岛素
- 二聚体 - α链和β链
- 通过2个二硫键连接
- HIV蛋白酶
- 二聚体
- 由相同的亚基组成
- 胶原蛋白
- 由3个螺旋状多肽链组成
- 甘氨酸出现在每三个残基处,因为螺旋中心没有空间
- 通过脯氨酸和羟脯氨酸残基的吡咯烷环的位阻排斥稳定
- 氢键将胶原蛋白纤维的链结合在一起

- 血红蛋白
- 由2个α和2个β组组成
- 呈球形
- 具有反向转角,有助于蛋白质的圆形形状
- 水通道蛋白
- 由6个α螺旋组成
- 形成疏水环
- 在细胞膜中形成四聚体,每个单体充当水通道
蛋白质的四级结构可以通过破坏将蛋白质结合在一起的共价和非共价力而变性。热量、尿素或盐酸胍会通过破坏非共价力而使蛋白质变性,而β-巯基乙醇会通过还原桥梁而破坏二硫键。
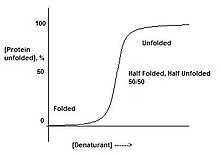
蛋白质要么折叠,要么不折叠。不存在蛋白质“半折叠”的阶段。这可以通过慢慢地向蛋白质中添加变性剂来观察。这将导致从折叠状态到未折叠状态的急剧转变,表明仅存在这两种形式。这是协同转变的结果。
例如,如果将蛋白质放入仅蛋白质的一部分不稳定的变性剂中,整个蛋白质将展开。这是由于多米诺骨牌效应,其中使蛋白质的一部分不稳定将反过来使结构的其余部分不稳定。当蛋白质处于对应于折叠和未折叠之间转变中间的条件时,存在50/50的折叠和未折叠蛋白质混合物,而不是“半折叠”蛋白质。
在讨论了处于一种结构或另一种结构之后,它们之间在原子水平上一定存在一些东西。不幸的是,这是一个仍在开发中的领域,还有许多研究正在进行。凝聚成核原理等理论关注蛋白质折叠的这个领域。
四级结构的性质
- 多肽链可以组装成多亚基结构
- 指的是亚基的空间排列及其相互作用的性质
如果将课堂上的每个学生视为一个不同的氨基酸,每个右手视为一个α-羧基基团,每个左手视为一个α-氨基基团,而头部视为R基团;那么通过将右手连接到左手,该班将形成一个多肽。“连接”手的“键”将是肽键。这可以被认为是蛋白质的一级结构。
然后,如果将学生“吸引”到其他相隔4个“键”的学生,那么这种结构将折叠成二级结构;即α-螺旋。如果将学生排成线,并将他们吸引到另一条线中相应的学生,他们将形成β-折叠片。
现在想象一下,头部或R基团在诸如个性或极性等方面有所不同,例如,相似相吸。性格更合得来的学生会聚在一起,例如,疏水区域通常会聚集在一起,并在周围被亲水区域包围。这构成了三级结构。
现在添加一个不同的类别,这个类别中的人会有他们自己的三级结构,这些新的人会进入并与原始类别发生反应,形成四级结构。
控制四级结构目前越来越引起学术界的兴趣。操纵蛋白质组装体有很多优势。首先,人们能够生长/合成对人类有益的酶。然而,使这些酶发挥作用是困难的部分。例如,固氮酶,能够将氮气固定为氨的酶,只能在有氧环境下与 ATP 作为能量来源一起发挥作用。此外,研究人员发现,固氮酶是由两种蛋白质组成的,一种用于 ATP 耦合电子来源,另一种是固氮的反应中心。这两种蛋白质组装在一起作为整体发挥作用。最近,科学家们去除了 ATP 耦合蛋白,并用钌配合物取代了它。事实证明,钌配合物可以在光照下提供电子。现在,科学家们不必处理耦合 ATP 的复杂化学反应,只需照射改造后的固氮酶即可使其发挥作用!其次,蛋白质组装体可以有很多临床/材料应用。铁蛋白是一个高阶蛋白质组装体家族,通常是 12 聚体或 24 聚体。先前的研究表明,它可以吸收大量的 Fe 离子。许多研究人员正在努力控制铁蛋白的缔合和解离,寻找药物输送、气体储存、金属回收等的解决方案。已经开发出许多方法来控制蛋白质组装。其中一些包括以下内容
1. 过渡金属导向。蛋白质中的金属中心很重要,不仅因为它们是反应中心,而且它们通过配位帮助稳定蛋白质的形状。许多氨基酸本身就是配体。半胱氨酸、组氨酸、赖氨酸是常见的。此外,研究人员可以通过半胱氨酸替换将无机配体工程化到蛋白质中。因此,引入无机配体极大地扩展了蛋白质组装的范围。


金属-配体键具有多种特性。最明显的是,它是一种强相互作用。它比氢键强,但比共价键弱。因此,金属-配体键很强,但又不那么强,以至于仍然是可逆的。从空间上讲,金属具有其配位方向,主要是八面体和四面体。这种性质为人类在空间上排列蛋白质提供了极大的便利。


2. 疏水相互作用。在水性环境中,具有疏水侧链的氨基酸倾向于聚集在一起,以最大程度地减少与水的接触。研究人员利用这种特性,将特定匹配的一对非极性氨基酸工程化到蛋白质中,以获得水溶液中的蛋白质寡聚体。
3. 盐桥。众所周知,氨基酸具有不同的 pI。因此,在特定 pH 值下,某些氨基酸带负电荷,而另一些带正电荷。如果蛋白质上的一个区域主要由带负电荷的氨基酸占据,而另一个区域由带正电荷的氨基酸占据,则蛋白质可以通过静电吸引聚集。然而,这种技术通常不是那么具有选择性。
正在研究更多指导蛋白质组装的技术,例如螺旋-螺旋。人类控制四级结构的潜力很有希望。