结构生物化学/有机化学/蛋白质
蛋白质分子包含由20种氨基酸序列组成的多肽链。这些氨基酸通过肽键连接在一起,肽键是由两个氨基酸缩合,并消除水分子而形成的。蛋白质的功能取决于其三级结构。蛋白质倾向于折叠成三维结构,这是由于氨基酸的序列。蛋白质还包含每个氨基酸的官能团。这些基团具有反应性,并有助于蛋白质功能。蛋白质还相互作用以及与其他大分子相互作用。蛋白质可以是刚性的或柔性的。这使得某些蛋白质可以存在于细胞的不同部位,例如细胞骨架或软组织中。
酶是催化化学反应的蛋白质。酶通过降低开始该反应所需的活化能来加速生物系统中的反应。
激素是体内作为化学信使的蛋白质。这些蛋白质被发送到身体的不同部位以发送或接收信息。激素在调节人体和保持体内稳态方面非常重要。一些蛋白质激素包括胰岛素、生长激素、促黄体激素 (LH)、促卵泡激素 (FSH) 和促甲状腺激素 (TSH)。这些蛋白质是糖蛋白激素的一部分。
转运蛋白也用于运输。例如,血红蛋白是一种金属蛋白(含有金属作为辅因子的蛋白质),它在铁的帮助下在红细胞中转运氧气。
运动蛋白帮助将化学能转化为机械能,这与生物体的肌肉运动有关。例如肌动蛋白和肌球蛋白。
保护性蛋白质通过释放、制造抗体、抵抗和破坏异物来保护细胞。抗体是γ球蛋白。
结构性蛋白质有助于维持生物体中各种生物成分(如细胞和组织)的结构。胶原蛋白、弹性蛋白、α-角蛋白、硬蛋白[检查拼写]和丝素蛋白都是有助于生物体形成的蛋白质例子。
储存蛋白质包含能量,可以在生物体的代谢过程中被消化。例子有鸡蛋卵白蛋白和牛奶酪蛋白。
膜蛋白包括受体和膜转运。细胞膜上的受体允许离子通过。这些阻止不需要的物体进入细胞。这些受体还决定细胞是否兴奋以产生动作电位。膜转运很重要,因为它允许离子、蛋白质和其他大分子穿过细胞膜。
外部蛋白 - 细胞外的蛋白质,存在于多细胞生物体中。
内部蛋白 - 位于细胞内部的蛋白质,执行细胞内需求的功能。
膜蛋白 - 嵌入膜双层或膜边缘的蛋白质,有助于细胞内相互作用。
病毒蛋白 - 通常是病毒的外壳
酶是加速反应速率的蛋白质。许多反应如果没有酶的参与是无法发生的。

该图显示了酶的存在如何降低活化能,从而加速反应。有酶的反应可以比没有酶的反应快100亿倍。酶的工作速度受底物和酶浓度、温度和pH的影响。
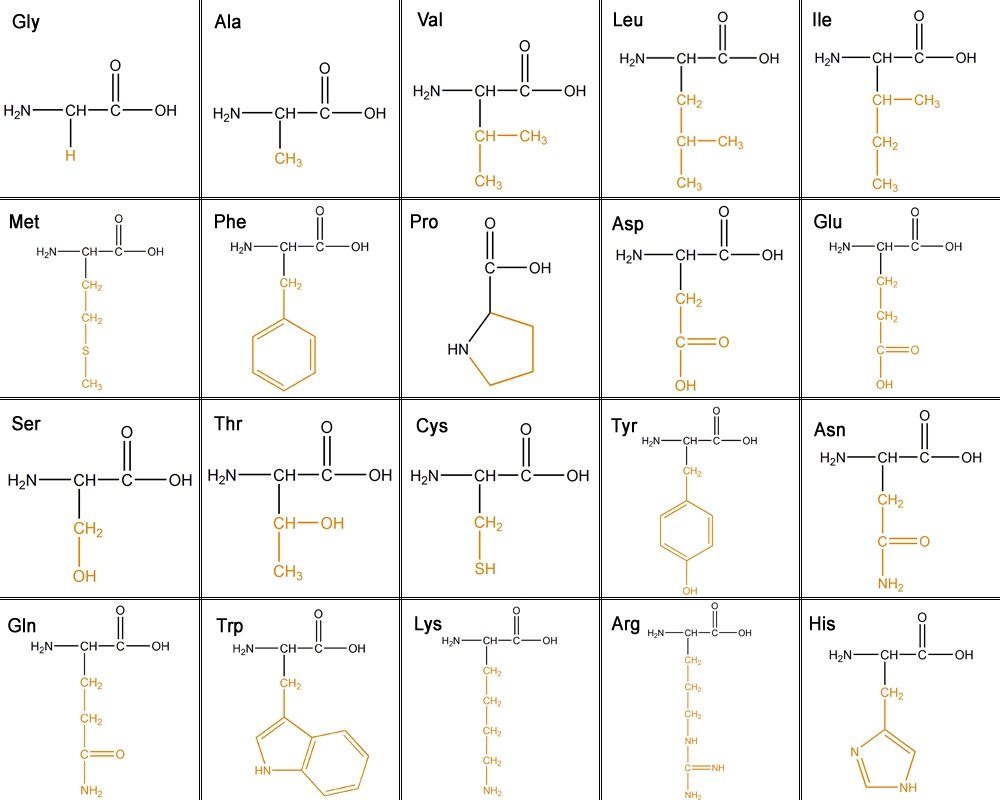
构成蛋白质的氨基酸有20种。主链具有一个N末端,即氨基基团 (NH2),和一个C末端,即羧基 (COOH)。侧链使每种氨基酸独一无二。
20种不同的氨基酸可以根据它们的侧链(R基团)分为六类。
1. 脂肪族 - 碳侧链。脂肪族链越长,疏水性越强。
甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸
2. 含羟基或硫 - OH具有反应性,亲水(喜水),极性和不带电荷。硫具有很强的反应性。
丝氨酸、苏氨酸、半胱氨酸、蛋氨酸
3. 环状 - 脯氨酸
4. 芳香族 -
苯丙氨酸 - 纯粹疏水性
酪氨酸 - OH具有反应性
色氨酸 - 由于其NH基团,疏水性较低
5. 碱性 - 亲水性和带正电荷。
赖氨酸、精氨酸、组氨酸
6. 酸性和其酰胺 - 带负电荷。
天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺
这是氨基酸在其非离子化形式下的通用结构。
此表显示了所有氨基酸及其侧链。从左到右依次是:甘氨酸 (Gly)、丙氨酸 (Ala)、缬氨酸 (Val)、亮氨酸 (Leu)、异亮氨酸 (ILe)、蛋氨酸 (Met)、苯丙氨酸 (Phe)、脯氨酸 (Pro)、天冬氨酸 (Asp)、谷氨酸 (Glu)、丝氨酸 (Ser)、苏氨酸 (Thr)、半胱氨酸 (Cys)、酪氨酸 (Tyr)、天冬酰胺 (Asn)、谷氨酰胺 (Gln)、色氨酸 (Trp)、赖氨酸 (Lys)、精氨酸 (Arg) 和组氨酸 (His)。
蛋白质由许多氨基酸组成。它们通过肽键连接在一起。肽键通过缩合反应形成,即失去一个水分子,以及羧基与氨基之间的反应。
上面的反应显示了两个丙氨酸如何通过肽键连接在一起。键是在n末端氨基和c末端羧基之间形成的。在这个反应中,两个氢原子和一个氧原子被释放出来,产生了水。由于羰基的共振,肽键几乎像双键一样。因此,该键没有旋转,因此构象受到限制。这限制了立体化学,因为蛋白质中几乎所有的肽键都是反式异构体,以限制R基团之间的空间位阻。只有脯氨酸可以是顺式或反式,因为这两种异构体所表现出的能量水平大致相同(脯氨酸的侧链与相邻R基团在两种异构体中的距离相似)。原因是脯氨酸的侧链与α-氨基形成一个环。脯氨酸是唯一侧链与α-氨基形成环的氨基酸。
结构
蛋白质可以折叠成四种不同的结构。这些结构决定了蛋白质的功能和特性。
一级结构 - 多肽的一级结构是指其氨基酸序列,从头到尾。多肽的一级结构由基因决定。基因携带制造具有特定氨基酸序列的多肽的信息。为了使蛋白质正常发挥功能,每个氨基酸都需要按基因分配的顺序排列。即使氨基酸序列中发生微小的变化也会影响蛋白质的形状及其功能能力。一个典型多肽的长度约为300个氨基酸,而一些基因编码的蛋白质长度则在几千个氨基酸左右。
二级结构 - 多肽的氨基酸序列,加上化学和物理定律,会导致多肽折叠成更紧凑的结构。氨基酸可以在蛋白质内的键周围旋转。这就是蛋白质具有柔韧性并能折叠成多种形状的原因。折叠可以是不规则的,或者某些区域可以具有重复的折叠模式。这种重复模式称为二级结构。两种类型是α-螺旋和β-折叠。在α-螺旋中,多肽主链形成一个重复的螺旋结构,该结构由氢键稳定。这些氢键以规律的间隔出现,导致多肽主链形成螺旋。在β-折叠中,多肽主链的区域彼此平行排列。当这些区域形成氢键时,多肽主链形成一个重复的锯齿形形状,称为β-折叠。
三级结构 - 由于一级结构,二级结构开始建立,多肽折叠并自身重叠以形成称为蛋白质三级结构的复杂三维形状。三级结构是单个多肽的三维形状。它通常是构成多肽的氨基酸的R基团之间的相互作用的结果。对于一些蛋白质,例如核糖核酸酶,三级结构是功能性蛋白质的最终结构。其他蛋白质由两个或多个多肽组成,并采用四级结构。三级结构在酶活性方面很重要。
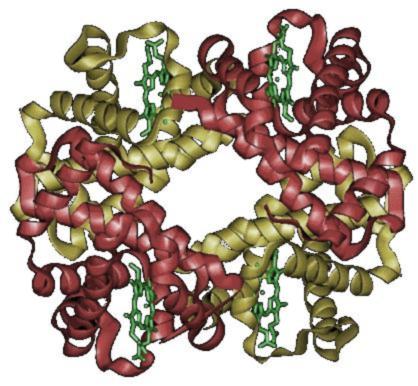
四级结构 - 大多数功能性蛋白质由两个或多个多肽组成,每个多肽都采用三级结构,然后彼此组装。单个多肽称为蛋白质亚基。亚基可能是相同的多肽,也可能是不同的。每个亚基都有一个非蛋白质成分,这对蛋白质的正常功能必不可少。这些成分被称为血红素。当蛋白质包含多个多肽链时,它们被称为具有四级结构,也被称为多聚体蛋白质,意思是许多部分。
影响蛋白质结构的因素
[edit | edit source]有几个因素决定了多肽如何采用它们的二级、三级和四级结构。多肽的氨基酸序列是区分一种蛋白质与另一种蛋白质结构的决定性特征。当多肽在细胞中合成时,它们折叠成二级和三级结构,这些结构组装成大多数蛋白质的四级结构。如前所述,化学和物理定律以及氨基酸序列共同控制着这个过程。五个因素对于蛋白质折叠和稳定性至关重要
1. 氢键
2. 离子键和其他极性相互作用
3. 疏水效应
4. 范德华力
5. 二硫键
图像显示了两个亚基,其中α亚基以红色显示,β亚基以黄色显示。
最近,蛋白质结构空间的性质在文献中得到了广泛的讨论。随着越来越多的证据表明几乎任何二级结构的排列都是可能的,并且整个蛋白质空间可以通过类似结构的路径穿越,传统上将蛋白质宇宙视为一组独立折叠的离散观点受到了批评。我们认为,离散描述和连续描述不是相互排斥的,而是互补的:从进化的意义上说,空间在很大程度上是离散的,但在量化纯粹的结构相似性时在几何上是连续的。进化连接主要局限于对应于折叠的独立结构原型,作为结构稳定性的岛屿,在岛屿之间只有少数可追踪的链接。然而,对于几何相似性度量,通常可以找到一个合理的临界值,该临界值会产生通过中间体连接任何两个结构的路径。
最近关于蛋白质结构空间起源的讨论很多。研究人员一直在争论蛋白质是由离散的结构组构成,还是一个连续体。传统上对不同结构折叠的看法受到了质疑,许多研究人员支持连续的看法。离散的观点认为蛋白质是独立的折叠,而连续的观点支持任何二级结构排列都可能的观点。研究人员并没有争论哪种观点是正确的,而是开始断言连续和离散的观点都代表了一种二元性,因为每个观点都是必要的,并且存在于蛋白质结构空间中。离散和连续的观点实际上是互补的,蛋白质结构空间在进化水平上是离散的,但在几何上是连续的。通过将某些折叠视为结构稳定性的岛屿来建立进化连接。为了查看蛋白质结构的几何相似性,我们看到了通过中间体连接任何两个结构的路径。
离散观点
传统的离散观点是在蛋白质结构中存在许多结构相似性的理念下发展起来的。这个理念是通过利用 X 射线晶体学来研究最早的蛋白质结构,即肌红蛋白和血红蛋白而发展起来的。科学家发现肌红蛋白和血红蛋白尽管序列不同,但结构相似。蛋白质结构中结构相似性的其他例子包括胰凝乳蛋白酶和胰蛋白酶、几个 TIM β/α 桶、罗斯曼折叠和免疫球蛋白样 β 三明治。所有这些结构都是独一无二且可识别的。
“折叠”的概念是用来描述蛋白质结构中的这种离散性。因此,新确定的结构可以被识别为这些清晰且可识别结构之一,或者可以用来建立一个“新的”折叠,以便其他蛋白质结构在未来可以识别它。这个理念得到了大多数结构与这些常见的蛋白质结构原型相匹配这一事实的支持。
TIM 桶折叠是原型的一个例子。大量的代谢酶属于 TIM 桶折叠原型。尽管这些家族中的大多数在序列方面没有显示出太多相似性,但 X 射线晶体学家在许多酶家族中发现了 TIM 桶。众所周知,这些 TIM 桶家族是由基因重复和代谢途径的积累产生的。
由迈克尔·罗斯曼发现的折叠是另一个突出的结构原型的例子。这种双重缠绕折叠通过两个右手βαβ单元被识别,这两个单元以中心对称的形式放置,在单元的第一条链之间形成氢键。
存在一个进化过程,即进化成一个热力学稳定的结构。发生的突变通过避开热力学稳定性而偏离进化过程。因此,这些突变的蛋白质被选择淘汰。驱动进化的稳定选择使得折叠之间的移动变得不常见。如果我们从进化的角度看待蛋白质结构空间,蛋白质的离散性是它的特征。
连续观点
许多出版物表明结构空间是连续的。TM 评分等相似性度量使科学家能够通过不超过七步来找到任何两个结构之间的连接。
连续空间不是由进化造成的,而是由氢键形成规则以及二级结构的反平行和平行排列造成的。连续的蛋白质结构空间也不涉及传递性。连续观点更多地涉及几何形状,几何形状也不具有传递性。
在一些出版物中,“折叠”一词受到质疑,因为将结构分类为不重叠的折叠会导致遗漏不同折叠中重要的功能性连接。
将常见结构与非常不同的几何形状分组对于分类和可视化非常有用。使用这些分组,例如之前讨论过的“TIM 桶”、“罗斯曼折叠”和“OB 折叠”,可能有助于确定结构和功能。另一方面,其他类型的“折叠”可能更加模糊,并且只针对某个进化组。以不同α-螺旋折叠的蛋白质为例。它们通常以螺旋堆积角度的渐进变化为特征,而不是离散的拓扑差异。在这些模糊的情况下,连续观点可能更合适。为了确定蛋白质功能,有必要研究结构相似性列表,而不仅仅是折叠分配,因为即使对于具有不同折叠的蛋白质结构,功能位点的放置和构象也可能是共同的。例如,TIM 桶和罗斯曼折叠具有离散不同的几何形状,并且它们的活性位点在 β 链和 α 螺旋之间具有相似的位置。
“折叠”是一个对 SCOP 分类(蛋白质结构分类)至关重要的术语,是建立蛋白质之间进化连接的标准。如果蛋白质具有相同的折叠,则意味着它们具有相同的 major secondary structural elements,并且具有相同的相互方向和连接性。这种类型的分类可能会造成问题,因为选择哪个二级结构是 major 的过程中涉及主观性。
“折叠”的定义更像是一种经验性的近似“艺术”,因为蛋白质的分类标准非常宽松,并且基于以下几点:结构数据、进化和功能考虑。
科学家现在正在使用一个修改后的术语,称为“新折叠”。使用这种案例,科学家很容易错过蛋白质结构与进化和功能之间的有意义的联系。
科学家们质疑了蛋白质结构空间的直接和实际价值。它们从根本上说很重要,尤其是在结构预测中是必要的。连续观点认为,如果存在大约 40% 的重叠结构,所有结构都是可预测的。这些观点可以应用的另一种方式是预测功能特性。离散和连续的观点都对蛋白质预测很有帮助。两种观点都适用于确定功能,因此不应该认为一种比另一种更重要,也不应该批评任何一种。
This idea of both continuous and discrete views playing a part in protein structure space suggests that there is a duality present in the nature of protein structure space. On an evolutionary standpoint, protein structure space is mostly discrete, and certain regions of stability correspond to certain protein folds. There are visible evolutionary connections between these regions. Geometrically speaking, the protein structure space is continuous. Any arrangement of secondary structures is possible, and almost any two structures can be connected by a path of intermediate and locally similar structures. An important note to remember about both discrete and continuous views is that homology is transitive, and homology is a property of discreteness; structure similarity is not. The continuous view is not transitive.
模型与结构
[edit | edit source]在蛋白质的研究和学习中,'结构'和'模型'之间存在混淆。模型经常与结构混淆,指的是基于分子相互作用(可以包括侧链和键)、分子之间的同源性或一般推理的模型排列。它通常是用于指导模型构建的实验中获取的数据的一部分。模型可以非常简单,也可以非常复杂。它可以包括代表 α 或 β 结构的箭头,或者箭头来显示路径。它们还可以显示测量值的约束。
蛋白质的结构是指原子与其共价键和非共价键之间的空间相互作用。结构通常是通过使用 X 射线晶体学、电子显微镜、核磁共振等实验获得的。电子显微镜和晶体学提供了空间分辨率的准确性,而核磁共振实验提供了有关原子排列及其配位的信息。[1]
蛋白质是在有机化学中制造、修饰和识别的。有机化学反应对于蛋白质的存在和功能是必要的。前面的部分讨论了将蛋白质连接在一起的反应。生物化学和有机化学的一个重要部分是识别蛋白质和确定氨基酸的连接顺序。识别这些序列允许与其他蛋白质进行比较。它们对于制造DNA和编码基因也很有价值。以下技术涉及有机化学,有助于识别蛋白质的序列。
埃德曼降解
埃德曼降解确定 N 末端的氨基酸。试剂苯异硫氰酸酯用于裂解 N 末端氨基酸,同时保持其余链完整。这对于识别短肽很有用。但是,如果链很长,确定序列将需要很长时间,因为它一次只能识别一个氨基酸。该方法的效率每次重复都会降低。因此,识别更长链的最佳方法是将它们分解成更小的肽进行分析。
化学裂解
溴化氰- CNBr 在蛋氨酸的羧基侧裂解链
邻碘酰基苯甲酸- 在色氨酸的羧基侧裂解
羟胺- 裂解天冬酰胺- 甘氨酸键
2-硝基-5-硫氰酸苯甲酸酯- 半胱氨酸残基的氨基侧
酶促裂解
胰蛋白酶- 在赖氨酸和精氨酸的羧基侧裂解
梭状芽孢杆菌蛋白酶- 在精氨酸残基的羧基侧裂解
金黄色葡萄球菌蛋白酶- 天冬氨酸和谷氨酸的羧基侧
凝血酶- 在精氨酸的羧基侧裂解
胰凝乳蛋白酶- 在酪氨酸、色氨酸、苯丙氨酸、亮氨酸和蛋氨酸的羧基侧裂解,主要是芳香侧链
羧肽酶 A- 除精氨酸、赖氨酸或脯氨酸外,裂解 C 末端氨基酸的氨基侧
蛋白质降解是一个重要的过程,它将蛋白质分解成更小的亚基氨基酸。降解发生是为了维持和为身体提供稳定的氨基酸量。错误折叠或受损的蛋白质会被分解,因为它们毫无用处,必须被破坏。膳食蛋白质也会被降解。膳食蛋白质包含体内无法合成的氨基酸,因此必须通过我们所吃的食物来获取。这些氨基酸被称为必需氨基酸,是重新合成新蛋白质的重要组成部分。
蛋白质首先在胃中被消化,胃中的酸性条件为蛋白质变性提供了最佳环境。低 pH 值使蛋白水解酶能够展开并降解蛋白质。胃蛋白酶是胃中发现的主要酶。蛋白质的进一步分解发生在肠腔中。胰腺是帮助分解蛋白质的蛋白水解酶的主要来源。泛素-蛋白酶体降解蛋白质是人体用来调节氨基酸供应的一种途径。一种较小的蛋白质称为泛素首先标记需要降解的蛋白质。这会在蛋白质上创建一个标记,信号蛋白酶体进一步消化它。
蛋白质完全消化后,游离氨基酸对应物通过血液运输并传递到必要的组织,以被吸收并用于新的蛋白质合成。游离氨基酸也可以在细胞呼吸过程中用作能量。氨基酸中的氨基必须首先被去除,以便碳骨架可以转化为碳水化合物或脂肪酸。氨基通过尿素循环进行处理,其中氮被清除。
Berg,生物化学,第 6 版
http://faculty.clintoncc.suny.edu/faculty/michael.gregory/files/bio%20101/bio%20101%20lectures/biochemistry/biochemi.htm
[1] Fandrich,Marcus,Schmidt,Matthias 和 Grigorieff,Nikoaus:Trends Biochem Sci. 2011 年 6 月;36(6)338-345。“了解阿尔茨海默病 β-淀粉样蛋白结构的最新进展”